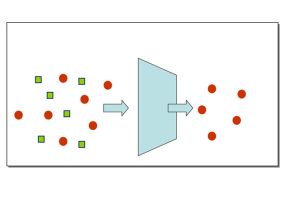
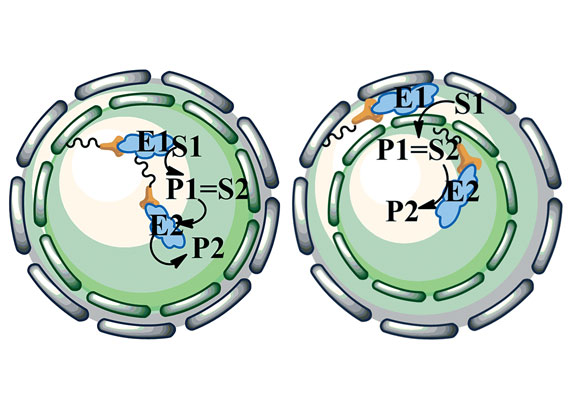
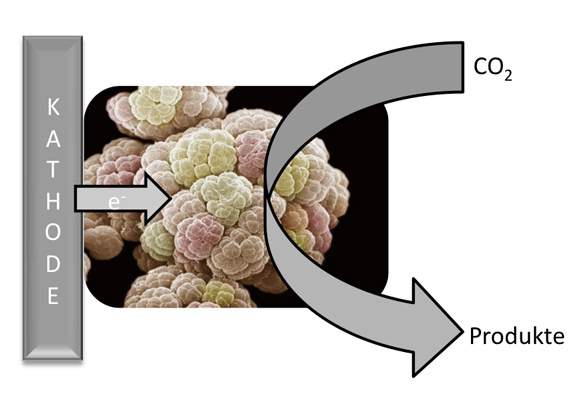
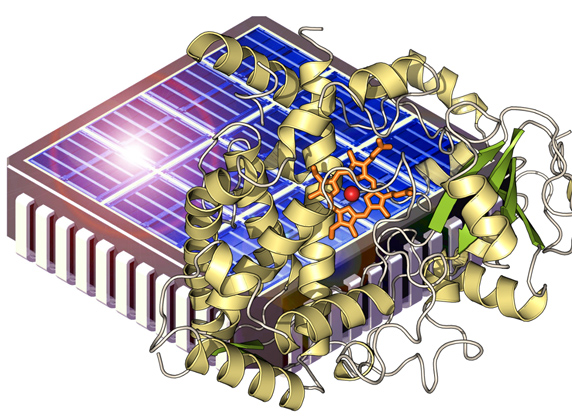
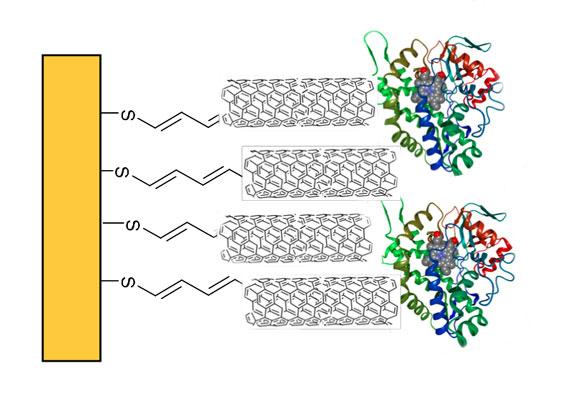
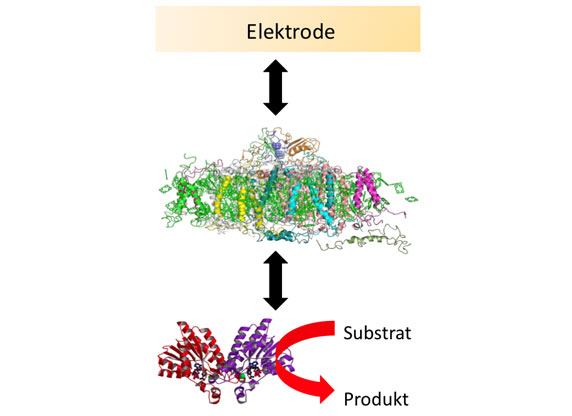
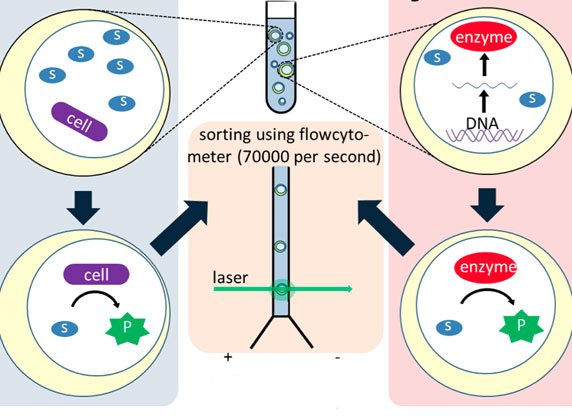
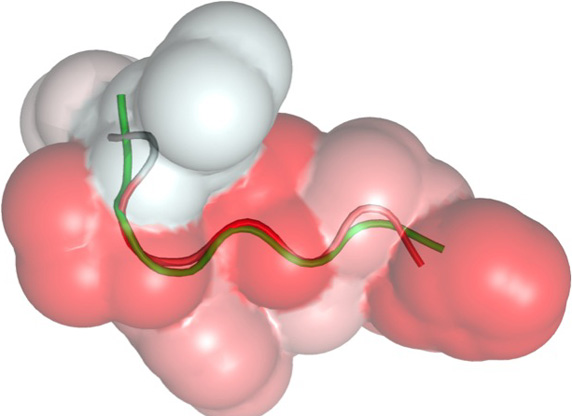
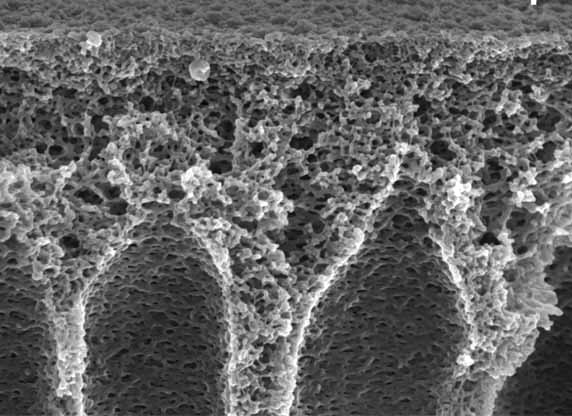
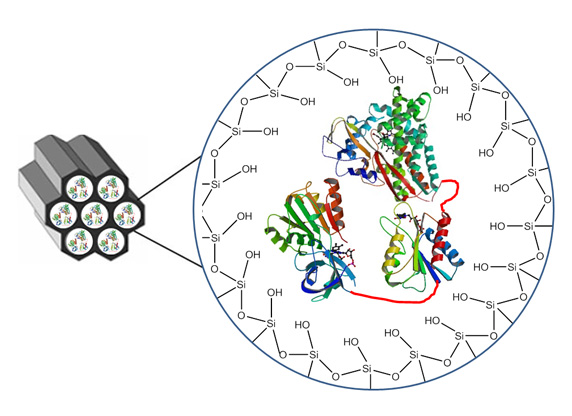
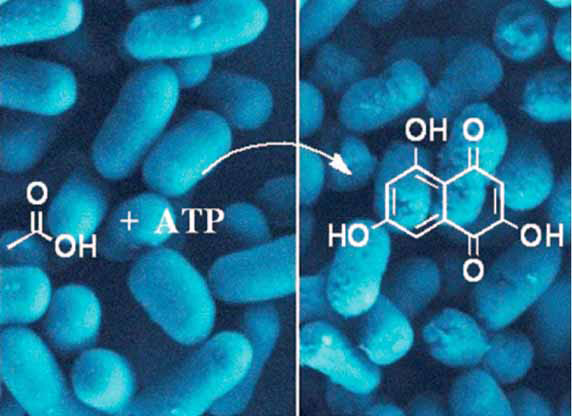
In der Bioanalytik werden – etwa in Trenn- und Affinitätssäulen – meist dichtgepackte Kügelchen eingesetzt. Ein anderes Konzept stellen die Monolithen dar, das sind homogene polymere Matrix-Strukturen, die von winzigen Poren durchsetzt sind. Ein Verbundprojekt namens „Bioliths“ um den Stuttgarter Polymerchemiker Michael Buchmeiser und den Biotechnologen Bernhard Hauer möchte ein innovatives monolithisches Trägermaterial entwickeln, das sich einmal als Reaktor für bestimmte Enzyme eignen soll. Hierbei sollen die Enzyme jedoch nicht in wässriger Umgebung arbeiten, sondern in ionischen Flüssigkeiten. Davon versprechen sich nicht nur die Forscher aus Stuttgart viel Potenzial für neue Produkte. Auch das Geesthachter Bioanalytik-Unternehmen GALAB Laboratories GmbH ist an dem Projekt beteiligt.