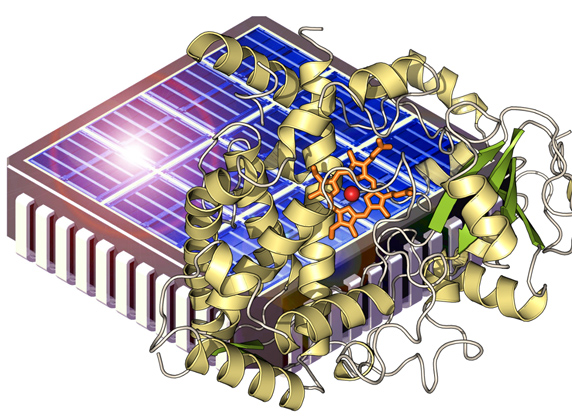
Unter der Koordination von Annette Beck-Sickinger vom Institut für Biochemie der Universität Leipzig will der Forscherverbund deshalb gleich die Abkürzung nehmen: Statt den Umweg über die Reduktionsäquivalente zu gehen, sollen die Elektronen den Monooxygenasen direkt über die Elektrode bereitgestellt werden. Das Ziel ist ambitioniert, scheiterten in den vergangenen Jahren doch schon so manche Ansätze, die Elektronen von der Elektrode weg für enzymatische Reaktionen nutzbar zu machen. Doch die bioorganische Chemikerin glaubt: „Nun ist die Zeit reif für einen neuen Versuch.“ Um sich weiß sie ein versiertes Team: Das ebenfalls in Leipzig beheimatete Biotechunternehmen c-LEcta ist Spezialist für das Design und die Herstellung von Enzymen. Die Firma soll sowohl über gerichtete Evolution als auch über rationales Design die Eigenschaften ausgewählter Monooxygenasen verbessern. Im Labor von Andrea Robitzki im Biotechnologisch-Biomedizinischen Zentrum in Leipzig sollen die Enzyme dann auf Mikrochips gebunden und der Elektronenfluss gemessen werden.
Auch Sträters Erkenntnisse der Strukturanalyse und Modellierung der Enzyme sollen in das Design einfließen. Die Monooxygenasen sollen nicht nur die Elektronen verlustfrei verwerten, sondern dabei auch noch so stabil sein und die Reaktion so effizient katalysieren, dass sie für biokatalytischen Anwendungen im größeren Maßstab nutzbar sind. „Die größte Herausforderung ist der Übergang der Elektronen von der Kathode zu den Enzymen“ erläutert der 48-jährige Westfale. Knacken will Beck-Sickinger das Problem mit Hilfe eines sogenannten Linkerpeptids. Dank des aus drei bis fünf Aminosäuren bestehenden Verbindungsstücks sollen die Enzyme gerichtet auf der Oberfläche der Elektrode angebracht werden. Die studierte Chemikerin und Biologin kennt sich im Fachgebiet Klick-Chemie aus. Auch das schnelle aber kontrollierte Anheften der Monooxygenasen an das Linkerpeptid soll nach den Regeln der Klick-Chemie erfolgen und so zum Beispiel auch in wässriger Lösung möglich sein. Falls es den Leipzigern tatsächlich gelingen sollte, Hydroxylierungsreaktionen mit Strom anzutreiben, dann dürfte dies weltweit für Aufmerksamkeit – und so manchen „Klick“ auf die Homepage des Verbundprojektes – sorgen. (ml)


