Den funktionellen Unterschied zwischen L- und D-Aminosäure beschreibt Proteiningenieur Ulrich Schwaneberg so: „Das ist wie bei linksgängigen und rechtsgängigen Schrauben. Für ein gegebenes Gewinde lässt sich nun mal nur eine Schraube verwenden, die andere ist nutzlos.“ Schwaneberg und Böker wollen gemeinsam stereoselektive Membranen herstellen, die D- und L-Geschwistermoleküle voneinander trennen können. „Gibt man zu einem Bioreaktor mit dieser Membran auf die Seite mit dem Aminosäurengemisch noch ein Enzym hinzu, das die beiden Aminosäurevarianten ineinander umwandeln kann, könnte man das racemische Gemisch nicht nur trennen, sondern alle Aminosäure in die ersehnte ‚Drehrichtung’ bringen. Die gewünschte – und zumeist teurere – D-Variante könnte man dann einfach auf der anderen Seite der Membran stetig abzapfen.“ Aufgrund der Preisunterschiede für D- und L-Aminosäuren sehen Schwaneberg und Böker im Erfolgsfalle ein großes Marktpotenzial für diese chirale Biohybrid-Membrantechnologie. Für Böker ist das indes nur der Anfang: „Eine Membran mit einer Vielzahl von kleinen, selektiven Löchern in einer definierten Größe auf Nanometerskala gibt es derzeit nicht.“ Gelingt es den Forschern eine sogenannte „Chirale Membran“ herzustellen, dann käme sie als ein Filter für hunderte Aufgaben in Frage.
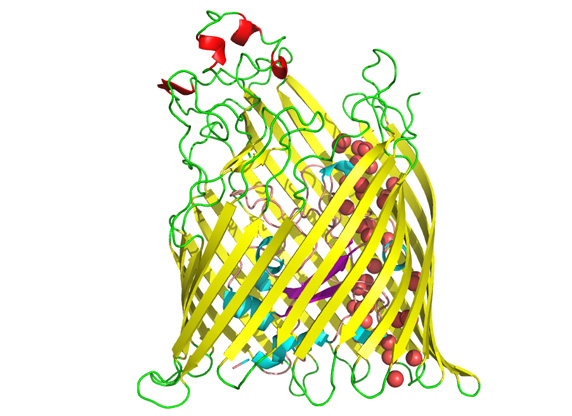
Bis dahin ist es aber noch ein weiter Weg. Schwaneberg konzentriert sich auf die Löcher, Böker um den Aufbau der Membran. Die Löcher werden durch ein ursprünglich aus Bakterien stammendes Transportprotein namens FhuA gebildet. Schwaneberg hat schon eine Reihe von Varianten davon in der Laborschublade – und forscht an weiteren. Bökers Aufgabe ist die Herstellung einer Membranfläche. Kein leichtes Unterfangen, denn die Transportproteine können bisher nur in Membranen von runden Vesikeln eingebaut werden. Doch das Forschungstandem hat schon mehrere Ideen, wie es viele dieser Transportproteine auf einer Oberfläche von ruhenden Wassertröpfchen zu einer Fläche verweben will: „An die FhuA-Proteine wollen wir eine Vielzahl von sich selbst organisierenden Polymerketten anbringen. Kommen diese Moleküle miteinander in Kontakt, ordnen sie sich von allein nebeneinander an. Dann helfen wir nur noch mit einer chemischen Reaktion, einer Polymerisierung ähnlich der Vulkanisierung von Gummireifen, nach – und erhalten eine stabile 2D-Membran“, erklärt Böker. Am Ende der Förderperiode soll in Aachen ein Demonstrationsreaktor stehen und die benötigten Transportproteine dort im 100-Liter-Maßstab hergestellt werden. Und die fertige Membran? „Wir schätzen, dass wir im Idealfall zwei mal zwei Zentimeter schaffen“, so Böker. (ml)


