1) Alternativen zur Zelle als Biofabrik
In der industriellen Biotechnologie-Produktion werden üblicherweise Mikroorganismen, aber auch tierische und pflanzliche Zellkulturen als lebende Fabriken eingesetzt, um Proteine und andere Stoffwechselprodukte wie Antibiotika, Aminosäuren oder Biopolymere herzustellen.
Als alternativer Ansatz zu diesen zellbasierten Verfahren hat sich ein weiteres Verfahren etabliert: die zellfreie Biosynthese. Zellfreie Produktionssysteme verzichten auf den Einsatz lebender Zellen. Die Synthese von Biomolekülen wie zum Beispiel Nukleinsäuren oder Proteine findet künstlich unter Einsatz aller notwendigen Komponenten in einem Reaktionsgefäß – also in vitro – statt.
Zellfreie Produktionssysteme haben im Vergleich zu zellbasierten Verfahren zahlreiche Vorteile. Der wichtigste ist die erheblich geringere Komplexität der Systeme: Mikroorganismen oder Zellen werden unter beträchtlichem Stoff- und Energieaufwand in Bioreaktoren kultiviert, da sie neben dem eigentlich gewünschten Biomolekül zusätzlich permanent eine Vielzahl lebensnotwendiger, zelleigener Proteine herstellen und diese mit ihrer Aktivität zu zahlreichen Nebenprodukten führen können. Löst man sich vom komplexen System Zelle und konzentriert sich nur auf die relevanten Syntheseschritte, so können spezielle Proteine oder andere Biomoleküle leichter, deutlich effizienter und in höherer Reinheit hergestellt werden.
Fachleute unterscheiden dabei zwei Ansätze:
• Zellextraktbasierte Systeme: Alle Bestandteile der Zellmaschinerie, die für die Biosynthese nötig sind, werden in einem Reaktionsgefäß vereint. Dafür werden durch Zellaufschluss sogenannte Lysate gewonnen. Sie kommen insbesondere bei der Proteinsynthese im Labor zum Einsatz (Kapitel 2).
• Enzymbasierte Systeme: Für Stoffumwandlungen werden statt ganzer Zellen nur die dafür benötigten isolierten Enzyme eingesetzt – diese katalysieren dann eine bestimmte Reaktion (Kapitel 3 und 4).
Da anders als bei zellbasierten Systemen die Schritte der Zellvermehrung und das Aufschließen der Zellen entfallen, ist die zellfreie Produktion in vielen Fällen günstiger, flexibler und erheblich schneller. Dieses Dossier erläutert das Potenzial der zellfreien Bioproduktion in Forschung und Entwicklung, beschreibt Grenzen dieses Ansatzes und stellt wichtige innovative Konzepte und Anwendungen vor.
Wir danken den Zellfreie-Biotechnologie-Experten Dr. Stefan Kubick (B4 PharmaTech GmbH, zuvor Fraunhofer IZI-BB) und Prof. Dr. Volker Sieber (TU München) für den wissenschaftlichen Faktencheck dieses Dossiers.
Seite 2 von 5
2) Zellfreie Biosynthese von Proteinen
Zellfreie Proteinsynthese-Systeme basieren auf der Verwendung der zellinneren molekularen Maschinerie zur Herstellung von Proteinen. Dazu zählen unter anderem die Ribosomen, Translationsfaktoren und Enzyme. Sie bewerkstelligen die für die Proteinherstellung notwendigen Prozesse der Transkription und der Translation.
In zwei Stufen zum Protein
Die Proteinbiosynthese ist ein zweistufiger Prozess, in dem die in der DNA gespeicherte genetische Information in ein Protein umgesetzt wird: Bei der Transkription erzeugt das Enzym RNA-Polymerase aus Nukleotiden eine einsträngige komplementäre Abschrift der DNA-Sequenz des Gens, die sogenannte messenger- oder Boten-RNA (mRNA). An den Ribosomen erfolgt dann die Translation, in der die Nukleotidsequenz in eine Aminosäuresequenz übersetzt wird. Definiert durch den Triplett-Code der Nukleotide werden Aminosäuren an eine aminosäurespezifische Transfer-RNA (tRNA) gebunden. In den Ribosomen werden die Aminosäuren dann durch Peptidbindung zu einer Kette verknüpft. Sobald diese Polypeptidkette das Ribosom verlässt, beginnt sie sich aufgrund chemischer und physikalischer Wechselwirkungen auf bestimmte Weise zu falten.
Wie gelangt man an die zelluläre Proteinsynthese-Maschinerie, um sie biotechnisch zu nutzen? Mithilfe spezieller Aufschlussverfahren werden die die Zellen umgebende Membranen aufgelöst und der Zellinhalt, das sogenannte Extrakt oder Lysat, für die Herstellung des gewünschten Proteins eingesetzt. Vielfach stammen die Lysate aus Modellorganismen wie dem Bakterium E. coli, für die Erzeugung komplexerer Proteine sind Pflanzenzellen (Weizenkeimextrakt, Tabak) und Tierzellkulturen (Hamsterzellen, Insektenzellen) etabliert. Zur Herstellung der relevanten Komponenten eines zellfreien Systems muss also immer auch ein zellbasierter Schritt vorgeschaltet werden, in dem also Zellen kultiviert und ihr Inhalt gewonnen wird.
Um nun ein Protein in vitro zu erzeugen, gibt man das Lysat zusammen mit der proteinkodierenden DNA-Sequenz sowie energieliefernde Stoffe und Aminosäuren in ein Reaktionsgefäß. Nun läuft die Synthese von allein ab. Innerhalb weniger Stunden erhält man das „fertige“ Protein. Die Aufreinigung und Gewinnung des erzeugten Proteins aus dem Reaktionsansatz sind vergleichsweise einfach. Insgesamt ist das ressourceneffizienter, schneller und kostengünstiger als zellbasierte Verfahren. Zudem lassen sich In-vitro-Synthesen hochparallelisiert und automatisiert durchführen.
Zellfreie Anfänge
Die früheste Grundlage für zellfreie Produktionssysteme stammt aus den 1960er-Jahren, als Marshall W. Nirenberg und Heinrich Matthaei mit dem sogenannten Poly-U-Experiment unter anderem zeigen konnten, dass bestimmte RNA-Moleküle als Matrizen fungieren, anhand derer Zellen Proteine herstellen können. Die ersten Synthesen größerer Proteinmengen in zellfreien Systemen erfolgten in den späten 1980er-Jahren im sogenannten CECF-Verfahren (Continuous-Exchange Cell-Free). Seither hat die Forschung intensiv untersucht, welche Parameter die zellfreie Biosynthese beschränken und wie sie sich optimieren lässt. Kommerzielle Systeme werden sowohl in prokaryotischen Organismen (Bakterien und Archaeen) wie auch für Systeme aus Eukaryoten (menschliche, tierische, pflanzliche und pilzliche Zellen) angeboten. Moderne zellfreie Produktionsplattformen liefern bis zu mehrere Milligramm Protein pro Milliliter.
Anwendungsbereiche in Forschung und Produktion
Die zellfreie Proteinsynthese hat sich als wichtiges Werkzeug der biomedizinischen Grundlagenforschung etabliert. Zellfreie Systeme kommen vor allem für solche Proteine zum Einsatz, die nicht mit herkömmlichen zellbasierten Systemen hergestellt werden können. Das sind zum Beispiel Membranproteine, die für die Pharmaforschung in hoher Reinheit für die Aufklärung ihrer Struktur oder ihres Funktionsmechanismus‘ in Milligramm-Mengen bereitgestellt werden können.
Darüber hinaus wirken viele pharmakologisch interessante und für die Forschung dringend benötigte Proteine in höheren Konzentrationen toxisch auf Zellen. Dadurch können wichtige Proteinklassen gar nicht oder nur in geringsten Mengen hergestellt werden. In der Herstellung zytotoxischer und schwer löslicher Proteine können zellfreie Biosynthesen daher ihre Vorteile ausspielen.
Da die In-vitro-Systeme sehr flexibel handhabbar und auf das Geschehen im Reaktionsgefäß direkt zugegriffen werden kann, finden sie auch beim Protein Engineering Verwendung. Dieser Begriff beschreibt einen Methoden-Mix, der zum Austausch von Aminosäuren des Proteins führt und so seine enzymatischen Eigenschaften für den Einsatz in bestimmten Prozessen optimiert.
Forschende aus der Synthetischen Biologie verwenden Aminosäuren, die modifiziert oder nicht-proteinogen sind, also in natürlichen Systemen nicht für die Proteinsynthese verwendet werden. Sie können jedoch wünschenswerte chemische Eigenschaften mit sich bringen, weshalb zellfreie Biosynthesen davon durchaus Gebrauch machen.
Für die Forschung von Vorteil ist zudem die Möglichkeit, markierte tRNAs in die Proteinsynthese einzuschleusen. So können die Forschenden später in ihren Studien sichtbar machen, wohin sich die so markierten Reporterproteine in den Zellen bewegen und mit welchen anderen Proteinen sie interagieren.
Gegenüber Produktionssystemen aus Bakterien oder Archaeen bieten solche aus Tier- und Pflanzenzellen einige Vorteile. So lassen sich hiermit sogenannte posttranslationale Modifizierungen der Proteine vornehmen. Dabei können chemische Gruppen der Proteine verändert oder hinzugefügt werden, um die Wirkung oder Bindungsspezifität der Proteine gezielt anzupassen. Solche Zellen eignen sich daher für die Herstellung von Biopharmazeutika, insbesondere Antikörpern. Zellfreie Systeme eignen sich zudem für die Herstellung von Antibody drug conjugates – Kombimoleküle, die etwa als Krebstherapeutika eingesetzt werden. Auch antimikrobielle Peptide und Cytokine lassen sich zellfrei herstellen.
Herausforderungen
Eine Herausforderung besteht darin sicherzustellen, dass sich die Peptidketten bei der Proteinsynthese auf die gleiche Weise falten, wie sie es in der Zelle täten – sonst kann das Protein seine normale Funktion nicht erfüllen. Zudem müssen kontinuierliche Prozesse entwickelt werden, die eine ausgewogene Versorgung an teuren energieliefernden Stoffen (ATP), Cofaktoren (Recycling) und Einzelbausteinen (Aminosäuren) garantieren. Das ist besonders für das Scale-up von zellfreien Bioproduktionsprozessen in den industriellen Maßstab relevant. Die Kostenwettbewerbsfähigkeit mit der zellbasierten Herstellung von biopharmazeutischen Proteinen ist erst in Einzelfällen erreicht.
Aktivitäten in Wissenschaft und Wirtschaft
Einen wichtigen Beitrag, um zellfreie Biosynthesen in die Praxis zu bringen, leistete von 2011 bis 2014 das Fraunhofer-Leitprojekt „Zellfreie Bioproduktion“, an dem sich acht Institute beteiligten. Entstanden ist daraus eine Technologie-Plattform, mit der die Forschenden unter anderem Antikörper hergestellt haben. Die Kosten konnten die Projektbeteiligten dabei gegenüber herkömmlichen Methoden – im kleinen und mittleren Produktionsmaßstab – um den Faktor zehn verringern. Das Bundesministerium für Bildung und Forschung (BMBF) förderte die Initiative mit rund 14,8 Mio. Euro, weitere Mittel stellte die Fraunhofer-Gesellschaft bereit.
Beispiele für Unternehmen, die auf die zellfreie Bioproteinsynthese setzen, sind Kykeon Biotech und LenioBio. Ersteres ist eine Ausgründung der TH Wildau und stellt rekombinante Proteine her, darunter Antikörper. Leniobio nutzt eine Technologie des Fraunhofer IME für die eukaryotische zellfreie Proteinexpression und hat sich der Synthese schwer herzustellender Proteine für alle Bereiche, darunter Biomedizin, Industrie und Landwirtschaft verschrieben.
Seite 3 von 5
3) Zellfreie enzymatische Einzelschrittreaktionen
Die zellfreie Biokatalyse ähnelt in vielen Punkten der zellfreien Bioproteinsynthese. Der Unterschied besteht darin, dass hier nicht Proteine hergestellt werden, sondern die katalytische Funktion von isolierten Enzymen für Stoffumwandlungen genutzt wird. Die für die gewünschte Stoffumwandlung erforderlichen Komponenten werden in das zellfreie Reaktionssystem eingebracht, in dem die gewünschte Stoffumsetzung dann abläuft.
Rein enzymatische Katalysen sind bereits seit vielen Jahren in der industriellen Produktion etabliert, besonders wenn es sich um Stoffwandlungen unter Beteiligung eines Enzyms oder weniger Enzyme handelt. Viele industriell relevante Enzymprozesse laufen unter Bedingungen ab, die für Mikroorganismen nicht geeignet sind (etwa die Stärkeverzuckerung, die bei 80 bis 105 Grad Celsius abläuft).
Wie bei der zellfreien Proteinsynthese gilt, dass auch hier die eingesetzten Enzyme zunächst hergestellt werden müssen – in der Regel in Zellen. Das ist bei Wirtschaftlichkeitsbetrachtungen und Lebenszyklus-Analysen zu berücksichtigen. Bei der zellfreien enzymatischen Katalyse unterscheiden Fachleute zwei Verfahren: die Einzelschrittreaktion, bei der ein bestimmtes Enzym einen Reaktionsschritt katalysiert, und die Mehrschrittreaktion, bei der eine Enzymkaskade einen komplexen, mehrschrittigen Syntheseprozess katalysiert (mehr dazu im Kapitel 4).
Enzymatische Einzelschrittreaktionen
Vor allem die Lebensmittelindustrie setzt seit Jahrzehnten einzelne Enzyme zellfrei ein. Meist handelt es sich dabei um hydrolysierende Enzyme, beispielsweise Proteasen, Amylasen, β-Glucanasen oder Pektinasen. Sie helfen bei der Stärkeverzuckerung, klären Fruchtsäfte, erzeugen Präbiotika oder verhindern, dass Backwaren schnell altbacken werden. Diese Enzyme werden bereits in sehr großen Mengen zu relativ günstigen Preisen (10 bis 50 Euro pro Kilogramm) von unterschiedlichen Herstellern angeboten.
Während die bisher genannten Beispiele flüssige Reaktionsumgebungen haben, gibt es auch Fälle, in denen Enzyme in immobilisierter Form wirken, das heißt die Enzyme werden zum Beispiel auf Trägermaterialien fixiert oder in Gelen eingebettet. So trennen Xylasen bei der Papierherstellung Lignin ab, was es erleichtert, das Papier zu bleichen und die Faserstruktur zu verbessern.
Insbesondere seit die Nachfrage nach Biokraftstoffen wächst, spielen auch hier zellfreie Enzymreaktionen eine Rolle. Cellulasen ermöglichen es, den wichtigen biogenen Roh- und Reststoff Lignocellulose zu verwerten. All diese Beispiele haben gemein, dass die beteiligten Enzyme vergleichsweise robust sind und für die jeweiligen Katalysen meist keine Cofaktoren oder andere hochwertige Substanzen benötigen. Cofaktoren sind Nicht-Proteinkomponenten, die für die Aktivität eines Enzyms unentbehrlich sind.
Zellfreie Impfstoff-Produktion
COVID-19-mRNA-Impfstoffe hatten und haben einen wesentlichen Anteil an der Bewältigung der Corona-Pandemie. Die Herstellung von mRNA-Molekülen im industriellen Maßstab stützt sich auch auf einen zellfreien Bioproduktionsschritt. Das Enzym RNA-Polymerase ist hier von zentraler Bedeutung. Zunächst wird der Bauplan für das Spike-Protein des SARS-CoV-2-Virus in ein Plasmid eingebaut und in Bakterien millionenfach vervielfältigt. Nach einem Reinigungsschritt wird die DNA in Einzelstränge geteilt. Nun kommt die RNA-Polymerase zum Einsatz: Mithilfe der benötigten molekularen Bausteine schreibt sie die DNA in einen komplementären mRNA-Strang um. Dieser Prozess dauert nach Angaben des Herstellers BioNTech drei bis vier Tage. Das Produkt wird gereinigt und dann in Lipid-Nanopartikel verpackt.
Bei der Produktion von Spezialchemikalien und Pharmazeutika bieten Enzyme den Vorteil, dass sie weit komplexere Verbindungen herstellen können als chemische Synthesen und nur jeweils die links- oder rechtsdrehende Form eines Moleküls erzeugen. Das ist bedeutsam, weil chirale Moleküle biologisch sehr unterschiedlich wirken können, obwohl sie Spiegelbilder voneinander sind. Beispiele für Enzyme für Einzelschrittreaktionen sind Transaminasen und Ketoreduktasen, die genutzt werden, um Arzneistoffe wie Esomeprazol gegen Magengeschwüre, Montelukast gegen Atemwegsleiden oder das Antidiabetikum Sitagliptin herzustellen.
Seite 4 von 5
4) Zellfreie Enzymkaskaden – in mehreren Schritten zum Produkt
Der Großteil der heutigen chemischen Produkte lässt sich nicht in einfachen Einschritt-Synthesen aus geeigneten Ausgangsmaterialien herstellen. Meist bedarf es mehrerer Syntheseschritte, um das Endprodukt zu synthetisieren. Klassischerweise erfolgen die einzelnen Syntheseschritte sequenziell und mit Aufreinigung der Zwischenprodukte. Diese Vorgehensweise ist ökonomisch und ökologisch ineffizient.
Zellfreie enzymatische Mehrschrittreaktionen – auch als Enzymkaskaden bezeichnet – haben hier enormes Potenzial. Sie reihen mehrere enzymatische Katalyse-Schritte aneinander, was im Ergebnis ein hocheffizientes, hochspezifisches Verfahren ermöglicht, um chemisch hochkomplexe Moleküle herzustellen.
Heute ist es bereits gelungen, komplette Stoffwechselwege bis hin zu den Produkten Ethanol, Isobutanol und Butanol als Enzymkaskade in einem Reaktionsgefäß zu realisieren. Deutlich wird der Vorteil der zellfreien Enzymkaskaden bei der Glykolyse, einem zehnschrittigen Prozess, der aus Glukose Pyruvat erzeugt. Anders als der natürliche Prozess in Zellen kann die zellfreie Enzymkaskade bei 50 bis 60 Grad Celsius betrieben werden, was zu höheren Reaktionsgeschwindigkeiten und damit einer besseren Produktivität führt. Indem man Enzyme kombiniert, die in der Natur nicht zusammen vorkommen, können derartige Kaskaden auch gegenüber den natürlichen Reaktionswegen vereinfacht werden. Eine artifizielle Glykolyse benötigt für die beschriebene Reaktion zum Beispiel statt zehn nur vier Enzyme. So lassen sich Kosten deutlich reduzieren.
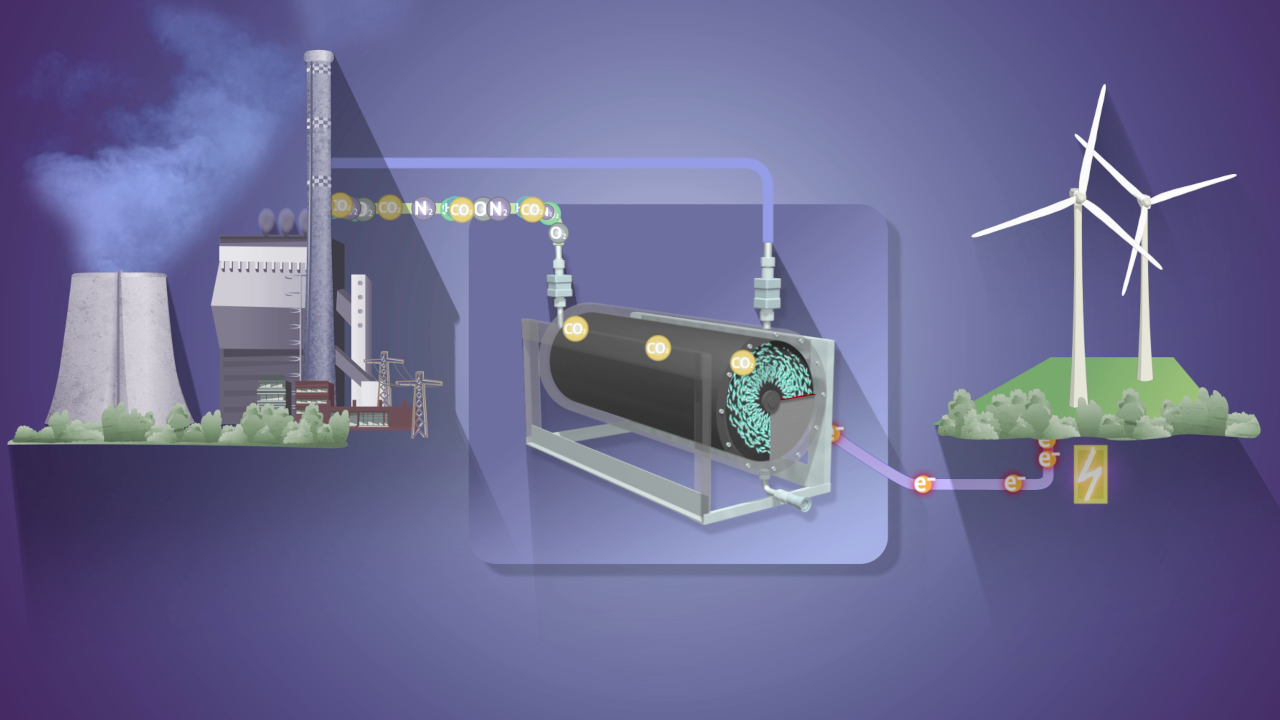
Die Möglichkeiten bei Mehrschrittreaktionen sind vielfältig. So haben Forschende um Tobias Erb mit dem CETCH-Zyklus eine 17-schrittige Enzymkaskade entwickelt, die das Treibhausgas Kohlendioxid als Substrat verwendet und daraus den Wertstoff Malat herstellt. Die Marburger Forschenden haben zudem ein Redox-Enzym entwickelt, das zu den effizientesten CO2 umwandelnden Biokatalysatoren der Welt zählt. Das machen sich Forschende im Fraunhofer-Max-Planck-Projekt eBioCO2n zunutze: Sie haben eine synthetische Enzymkaskade konzipiert, mit der sich stromgetrieben CO2 zur Herstellung von Spezialchemikalien nutzen lässt.
Für Aufsehen sorgte im Jahr 2021 auch eine chinesische Forschungsgruppe, die einen Stoffwechselweg aus elf Reaktionsschritten namens ASAP entwickelt hat, mit dem man aus Kohlendioxid Stärke synthetisieren kann. In Pflanzen braucht es dafür etwa 60 Schritte. Ein Team um Volker Sieber hat eine Art künstliche Photosynthese für die Herstellung von Aminosäuren aus CO2 entwickelt: CO2 wird mit Ökostrom und Wasserstoff zu Methanol verarbeitet. Synthetische Enzyme verwandeln dieses Zwischenprodukt dann in einem mehrstufigen Verfahren sehr effektiv und in hoher Ausbeute in die Aminosäure L-Alanin. Das Team um Tobias Erb hat wiederum einen künstlichen Stoffwechselweg konstruiert, bei dem das Zwischenprodukt Ameisensäure eine wichtige Rolle spielt.
Dieses Erklärvideo geht auch auf zellfreie Prozesse in nachhaltigen Bioraffinerien ein
Rationales Design
Fachleute konzipieren neue Enzymkaskaden heute meist nach dem Prinzip des rationalen Designs und der Herangehensweise der Synthetischen Biologie: Ausgehend vom Zielmolekül teilen sie die Reaktionskette gedanklich in Untereinheiten. Danach kombinieren sie enzymatische Reaktionen und manchmal auch chemische Synthesen, um die Einzelschritte korrekt zusammenzufügen.
Per Immobilisierung der Enzyme auf einem Trägermaterial – der sogenannten Matrix – wollen Forschende die Biokatalysatoren nah zueinander bringen, damit das Produkt des einen Enzyms direkt beim nächsten Enzym landet, für das es das Substrat darstellt. So könnten Reaktionen besonders effizient ablaufen.
Eine zentrale Herausforderung, ist es, diese Konzepte tatsächlich in die industrielle Anwendung zu überführen. So gilt es, die Reaktionsbedingungen so zu wählen, dass möglichst alle beteiligten Enzyme einer Kaskade hinreichend aktiv sein können.
Kommerzielle Anwendung finden zellfreie Mehrschrittreaktionen beispielsweise bei Eversyn in Marburg, um Nukleotidzucker und Oligosaccharide herzustellen.
Seite 5 von 5
5) Ausblick: Smarte Ansätze kombinieren
Innovative Verfahren und Technologien der Biochemie und der Molekularbiologie haben bei vielen Forschenden und Unternehmen die Hoffnung geweckt, noch effektivere Ansätze für die zellfreie Proteinsynthese und Enzymprozesse entwickeln zu können.
KI-basiertes Enzym-Engineering
So gibt es große Fortschritte dabei, Enzyme zu modellieren, um Rückschlüsse darauf zu ziehen, wie deren Bausteine verändert werden müssen, um bestimmte Eigenschaften zu erzielen. Das kann enorm viel Entwicklungszeit einsparen. Künstliche Intelligenz ist hier ein wichtiges Hilfsmittel. Moderne IT-Methoden helfen auch, die Moleküldynamiken in den aktiven Zentren besser zu verstehen und die Interaktion von Enzym und Substrat zu optimieren. Viele moderne Ansätze sind noch in der Entwicklung – vom Rationalen Design bis hin zum Enzym-Engineering.
Cofaktoren und Energieträger regenerieren
Damit bei einem Biotech-Prozess am Ende eine möglichst hohe Produktausbeute steht, braucht man für die Enzyme oft auch die passenden Cofaktoren. Diese kleinen, organischen Moleküle werden im Lauf jeder einzelnen Reaktion verbraucht und müssen regeneriert werden, um wieder einsatzfähig zu sein. Sie in großen Mengen neu bereitzustellen, ist sehr teuer und damit für die Industrie unwirtschaftlich. Deshalb werden in der Biotechnologie-Branche Konzepte für die Cofaktor-Regeneration erarbeitet. Auch die Energieversorgung der zellfreien Systeme kann über regenerative Konzepte gelöst werden. Zudem sind die Cofaktoren sehr instabil, sodass an robusteren Alternativen gearbeitet wird.
Zellfreie Bioproduktion in der BMBF-Förderung
In folgenden BMBF-Fördermaßnahmen wurden und werden Projekte zur zellfreien Bioproduktion bearbeitet:
• Basistechnologien für die nächste Generation biotechnologischer Verfahren (Biotechnologie 2020+)
• Zukunftstechnologien für die industrielle Bioökonomie: Schwerpunkt Biohybride Technologien
• Maßgeschneiderte biobasierte Inhaltsstoffe für eine wettbewerbsfähige Bioökonomie
Smarte Bioreaktoren mit Strömungstechnik
Längst blicken die Fachleute auch nicht mehr nur auf einzelne Biokatalysator-Moleküle, sondern auf Multienzymkomplexe, an denen Mehrschrittreaktionen auf engem Raum ablaufen könnten. Von Interesse sind zudem Fusionsproteine, bei denen durch genetische Veränderungen zwei Proteine zusammenlagern. Ihre aktiven Zentren liegen dadurch dicht beieinander, was bei Redox-Reaktionen günstig für den Cofaktor ist, aber auch generell die Reaktionsgeschwindigkeit verbessert. Auch die Geometrien von Matrizen und Reaktoren werden stetig optimiert, um die Prozesseffizienz zu verbessern. Prozesstechnisch ist es außerdem schwierig, die im Labormaßstab entwickelten Bedingungen für Enzymkaskaden auf industriell relevante Dimensionen hochzuskalieren.
Eine Hoffnung ruht hierbei auf der sogenannten Flow Chemistry, einer kontinuierlichen Strömungstechnik in miniaturisierten Fließbettreaktoren. Immobilisierte Enzyme existieren hier in verschiedenen Kompartimenten, die optimal miteinander gekoppelt werden können. ContiVir, ein Spin-off des Max-Planck-Instituts für Dynamik komplexer technischer Systeme in Magdeburg, entwickelt einen solchen Reaktor derzeit um Wirkstoffe für eine virale Gentherapie herzustellen.
Vielfach befinden sich zellfreie Systeme noch in der Konzeptions- und Erprobungsphase. Die größte Herausforderung ist der Schritt in die industrielle Anwendung. Forschende konzentrieren sich hier darauf, Kosten zu senken und langlebige und besonders ergiebige Produktionssysteme zu entwickeln. Großes Potenzial liegt zudem in der intelligenten Kombination von In-vitro-Systemen und zellbasierten Systemen, etwa zur Erprobung synthetischer Stoffwechselwege in der Synthetischen Biologie.