Enzymatische Bindung von Kohlendioxid verstehen
Forschende haben die Struktur des Enzymkomplexes Eisen-Nitrogenase aufgeklärt, um dessen Funktion besser nutzen zu können.
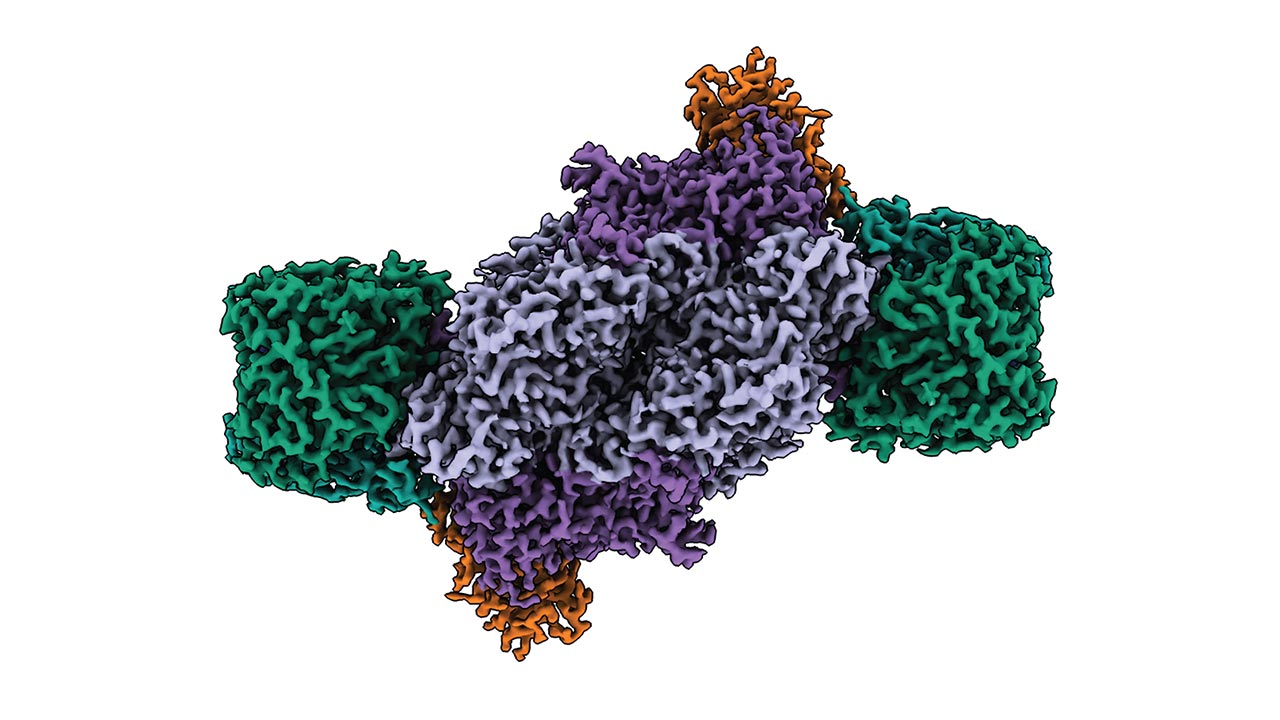
Stickstoff ist ein wichtiger Nährstoff für alle Lebewesen. Unsere Atmosphäre ist voll davon, doch die einzigen Lebewesen, die diesen Stickstoff direkt binden und nutzen können, sind einige Mikroorganismen. Sie verwenden dazu bestimmte Enzmye, sogenannte Nitrogenasen. Forschende interessieren sich jedoch noch aus einem zweiten Grund für diese Enzyme: Nitrogenasen können Kohlendioxid und Kohlenmonoxid binden und daraus Methan oder Ethylen bilden. Problematische Abfallstoffe werden so zu wertvollen chemischen Ressourcen.
Struktur der Eisen-Nitrogenase aus Purpurbakterium
Wie das Enzym jedoch im Detail funktioniert, war bislang unbekannt. Das zu verstehen, wäre jedoch wichtig, um es weiter zu optimieren und technisch besser nutzen zu können. Ein Team um Johannes Rebelein vom Max-Planck-Institut für terrestrische Mikrobiologie in Marburg hat es nun geschafft, die Struktur der Eisen-Nitrogenase zu entschlüsseln. Die Eisen-Nitrogenase kann Kohlendioxid besonders gut verwerten.
Für ihr Experiment nutzten die Forschenden ein Enzym aus dem Purpurbakterium Rhodobacter capsulatus. Die Wissenschaftler analysierten das gereinigte Enzym mittels kryogener Elektronenmikroskopie an der Central Electron Microscopy Facility am Max-Planck-Institut für Biophysik in Frankfurt am Main. Schwerpunkt der Analyse waren mögliche Besonderheiten im aktiven Zentrum des Enzymkomplexes, das die eigentliche Reaktion katalysiert.
Cofaktor enthält als einziges Metall Eisen
Dort zeigte sich, dass der Cofaktor im aktiven Zentrum lediglich Eisen, aber kein anderes Metall enthält – ein eindeutiger Unterschied zu anderen Nitrogenase-Typen. Ansonsten aber war das aktive Zentrum überraschend unauffällig: „Wir hatten erwartet, dass der Hauptunterschied zwischen der Fe-Nitrogenase und anderen Nitrogenase-Formen wie der Molybdän-Nitrogenase in der Architektur des Cofaktors im aktiven Zentrum und seiner unmittelbaren Umgebung liegt“, berichtet Frederik Schmidt, Erstautor der im Fachjournal „Nature Structural & Molecular Biology“ veröffentlichten Studie. „Zu unserer Überraschung stellten wir jedoch fest, dass die aktiven Zentren der drei Nitrogenase-Isoformen, trotz ihrer Unterschiede in den katalytischen Eigenschaften, einander sehr ähnlich sind.“
Besondere Symmetrie und wichtige Untereinheit
Allerdings förderte die Strukturanalyse an anderer Stelle Besonderheiten zu Tage: Nitrogenase ist aus zwei symmetrischen Hälften zusammengesetzt. Die Form der Symmetrie bei der Eisen-Nitrogenase unterscheidet sich jedoch von jener der Molybdän-Nitrogenase. „Die veränderte Symmetrie, die wir in der Fe-Nitrogenase beobachtet haben, könnte ihre besondere Reaktivität erklären“, erläutert Luca Schulz, Mit-Erstautor der Studie.
Eine weitere Erklärung könnte die bereits bekannte G-Untereinheit des Enzymkomplexes liefern. Sie ist eine spezielle Eigenschaft der Eisen-Nitrogenase. Ihre Struktur legt drei mögliche Funktionen nahe: Sie könnte den Elektronentransfer koordinieren, das Substrat kanalisieren und auch den Cofaktor im aktiven Zentrum stabilisieren.
Weitere Aufklärungen, wie die Eisen-Nitrogenase genau funktioniert, sollen dazu beitragen, künftig neue Biokatalysatoren zu entwickeln, die nachhaltig Stickstoff verwerten oder CO2 nutzen könnten, um Wertstoffe daraus zu erzeugen.
bl


