Enzym Nitrogenase in 3D durchleuchtet
Freiburger Forscher haben die 3D-Struktur eines Enzyms entschlüsselt, das zur Biotech-Produktion von Stickstoffdünger und Treibstoff eingesetzt werden kann.
Die Vanadium-Nitrogenase ist ein Enzym, das zwei wichtige Prozesse katalysiert. Sie fixiert Stickstoff (N2) aus der Luft und verstoffwechselt Kohlenmonoxid (CO). Das Enzym erzeugt so bioverfügbaren Stickstoff und kurzkettige Kohlenwasserstoffe. Beide Vorgänge werden heute in großem Maßstab mittels chemischer Katalyse durchgeführt, um Ammoniak und Kraftstoffe für die Industrie herzustellen. Ammoniak wird auch für synthetischen Stickstoffdünger benötigt, der für rund die Hälfte der Weltbevölkerung die Nahrungsmittelproduktion sichert. Nun haben Forscher der Universität Freiburg im Breisgau erstmals die 3D-Struktur des Enzyms beschrieben, das beide Reaktion biokatalytisch durchführt. Sie veröffentlichten ihre Ergebnisse im Fachjournal „Nature Chemical Biology“.
Spezielle Nitrogenase fixiert zusätzlich Kohlenmonoxid
Die Vanadium-Nitrogenase stammt aus dem freilebenden Bodenbakterium Azotobacter vinelandii und gehört zur Enzym-Familie der Nitrogenasen. Diese Enzyme sind auf die Fixierung von Luftstickstoff spezialisiert. Für die Biokatalyse benötigen sie in der Regel Eisen- und Molybdän-Moleküle als sogenannten Cofaktor. Die spezielle Nitrogenase aus Azotobacter vinelandii verwendet anstelle von Molybdän Vanadium und wird deshalb auch als Vanadium-Nitrogenase bezeichnet. Das Enzym katalysiert nicht nur die Fixierung von Stickstoff, sondern wandelt auch Kohlenmonoxid in kurzkettige Kohlenwasserstoffe um. Es gilt deshalb auch als „Two-Hit-Wonder“. Allerdings ist die Funktion dieses komplexen, metallhaltigen Enzymsystems ist bislang nur unvollständig geklärt.
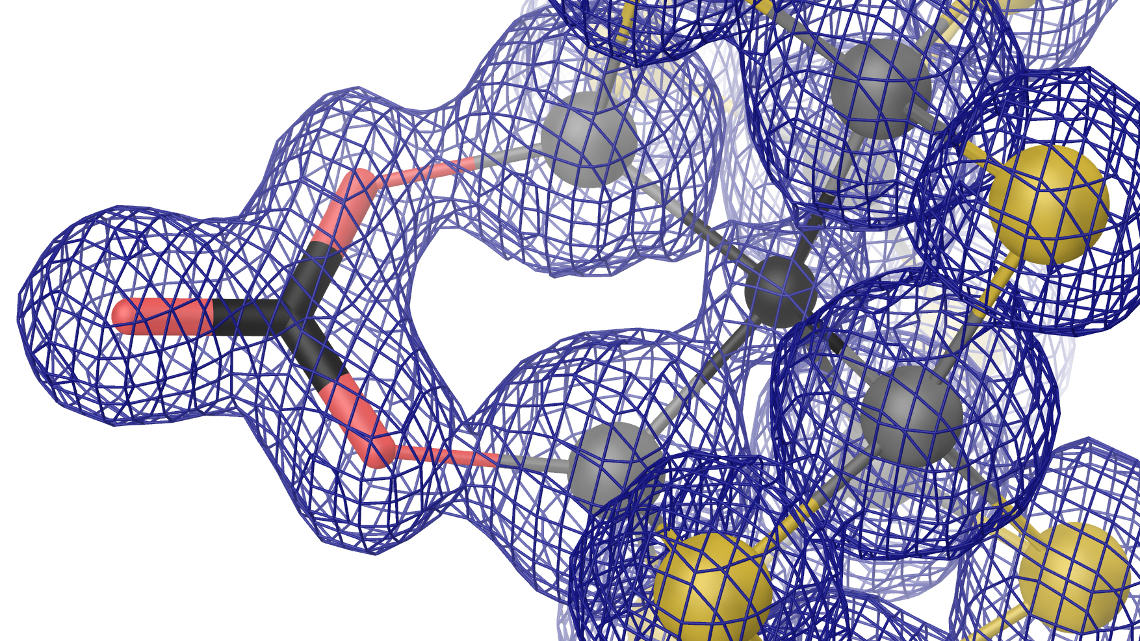
3D-Struktur der Vanadium-Nitrogenase entschlüsselt
Die Freiburger Forscher haben nun die dreidimensionale Molekülstruktur der Vanadium-Nitrogenase entschlüsselt. „Dazu haben wir das Enzym zunächst kristallisiert und anschließend die 3D-Struktur bei einer Auflösung bis auf Ebene einzelner Atome durch Röntgenbeugungsexperimente aufgeklärt“, so Daniel Sippel aus der Biochemie-Arbeitsgruppe. „Wir konnten zeigen, dass neben dem Vanadium an Stelle des Molybdäns im Cofaktor auch ein Schwefelion durch ein Carbonat-Anion ersetzt ist“, erklärt Oliver Einsle, Biochemie-Professor an der Universität Freiburg. „Das hat weitreichende Auswirkungen auf die geometrische und elektronische Struktur.“
Biotechnologisches Potenzial
Heute nutzt die Industrie und Landwirtschaft vor allem großtechnische chemische Verfahren zur Bindung von Stickstoff oder zur Herstellung von Kohlenwasserstoffen. Die Verfahren wurden Anfang des 20. Jahrhunderts entwickelt. Synthetischer Stickstoff-Dünger kann so mittels Haber-Bosch-Verfahren produziert und Kohle zu Treibstoffen mit der Fischer-Tropsch-Synthese umgewandelt werden. Das Haber-Bosch-Verfahren kann nur bei hohem Druck und 400 bis 500 Grad Celius erfolgen und benötigt entsprechend viel Energie. Das Fischer-Tropsch-Verfahren ist seit den 1990er Jahren wieder stärker in den Fokus geraten, da Treibstoff so nicht nur aus Kohle sonder auch aus Biomüll, Holz und landwirtschaftlichen Abfällen hergestellt werden kann. Seit 2009 sind FT-Treibstoffe für die Luftfahrt zugelassen. „Unser langfristiges Ziel ist es, die Nitrogenase biotechnologisch nutzbar zu machen“, so Einsle. Die Vanadium-Nitrogenase könnte eine Alternative zu den großtechnischen chemischen Verfahren bieten.
bp


