Konventionelle chemische Prozesse sind oft nicht besonders umweltfreundlich: Sie verlaufen bei hohen Temperaturen und Drücken, was viel Energie erfordert. Außerdem fallen meist Neben- oder Abfallprodukte an. Deshalb interessiert sich die Branche zunehmend für biokatalytische Alternativen, die zudem noch weit komplexere Moleküle ermöglichen. Dabei erfolgt die chemische Reaktion mit Hilfe von Enzymen, die hoch spezifisch und unter milden Bedingungen arbeiten. Schließlich hatte die Natur Millionen Jahre Zeit, die Struktur der Enzyme für ihre katalytische Aktivität zu optimieren. Die für eine bestimmte Reaktion geeigneten Enzyme zu identifizieren, ist jedoch aufwendig. Auch sind für eine wirtschaftliche Nutzung meist noch eine Reihe von Anpassungen für Enzym und Prozess notwendig.
Enzyme für C-C-Bindungen gesucht
Vor allem für Reaktionen, bei denen zwei Kohlenstoffatome verknüpft werden müssen – zu sogenannten C-C-Bindungen –, gibt es in der Industrie noch einen Mangel an geeigneten Enzymen. Dabei sind diese Reaktionen auf herkömmlichem Weg besonders problematisch: Sie erfordern meist starke Basen bzw. Säuren oder seltene Edelmetalle und erzeugen große Mengen an Salzen oder giftigen Abfallstoffen. Hier setzt das von der EU mit rund 8,2 Mio. Euro geförderte Projekt „CarbaZymes – Sustainable industrial processes based on a C-C bond-forming enzyme platform“ an. Vier Jahre lang suchten 14 Partner aus Hochschule und Industrie in Deutschland, Spanien, Niederlande und Großbritannien nach prozessrelevanten Enzymen, die C-C-Bindungen erzeugen und so in einer Aldolreaktion Vorstufen für verschiedene Bulkchemikalien und pharmazeutisch wirksame Substanzen herstellen. Welche das sind, basierte auf einer Analyse des Marktbedarfs durch die Industriepartner des Projekts.
Mehr als 1.000 Kandidatengene analysiert
„Wir wollten die Methodenentwicklung vorantreiben und eine große Palette neuer Enzyme bereitstellen“, erläutert Projektleiter Wolf-Dieter Fessner, leiter der Arbeitsgruppe Organischer Chemie an der TU Darmstadt, die Kernaufgabe der Forscher. Noch zu Beginn des Projekts war der beste Weg, geeignete Enzyme zu erzeugen, mittels zufallsgetriebener Mutagenese Enzymvarianten zu generieren und zu testen. Ein anderer Ansatz ist es, in Datenbanken verschiedene Enzymvarianten zu identifizieren, die unterschiedliche Wege der natürlichen Evolution hinter sich haben, entsprechend unterschiedliche Sequenzen besitzen und doch biologisch die gleiche Funktion erfüllen. Nutzt man die volle Bandbreite an Sequenzdiversität der entsprechenden Datenbanktreffer, lassen sich auch so Enzyme identifizieren, die für die geplanten nicht-natürlichen Zwecke besonders geeignet sind. „Wir mussten nicht mehr mit Klonierung oder Mutagenese beginnen, sondern konnten direkt mit dem gezielten Screening starten“, stellt Fessner die Vorteile der jüngeren Entwicklung heraus. Mehr als 1.000 Kandidaten hat das Projekt schließlich auf diese Weise analysiert, vielversprechende Kandidaten identifiziert, weiter analysiert und einige davon weiter optimiert.
Die Suche nach neuen, effizienten Enzymen beginnt mit der Analyse von Gen-Datenbanken für die Erzeugung maximal diverser Kollektionen von Proteinfamilien.
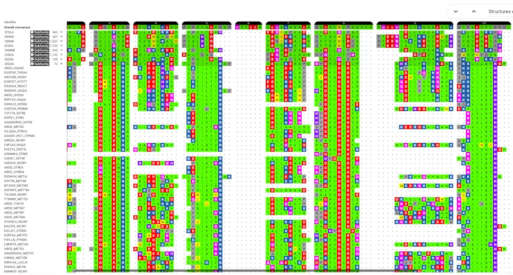
Neue Algorithmen für Prognosen zu den Enzymen
Bislang gab es für die Aldolreaktion vor allem Enzyme, die aus einem definierten Substrat ihr Produkt herstellen konnten. Erstrebenswert wären jedoch Enzyme, die mehrere Substratkombinationen umsetzen können, um die Anwendungsbreite zu steigern. „Außerdem mussten wir die Bioinformatik weiter entwickeln, um aus der Datenbank nicht nur die Strukturen der Enzyme abfragen zu können, sondern auch deren Stabilität vorhersagen zu können und wie sich diese durch gezielte Punktmutationen verändern würde“, ergänzt Fessner. Neue Algorithmen waren gesucht, die eine Optimierung kompletter Mehrschritt- und Mehrsubstratreaktionen erleichtern können.
Nachhaltiger Prozess für Homoserin-Herstellung entwickelt
Herausgekommen ist unter anderem ein nachhaltiger Prozess für die Herstellung der Aminosäure Homoserin durch drei gekoppelte Enzymreaktionen. „Wir haben den Prozess komplett auf Biokatalysen umgestellt“, resümiert Fessner, „aber wir haben noch nicht die wirtschaftlich notwendige Effizienz für den Gesamtprozess erreicht.“ Das allerdings wäre wohl nur eine Frage der Zeit, wenn die Industriepartner das Vorhaben weiter in Richtung Ganzzellbiokatalyse verfolgen würden. Auch bei einem weiteren Prozess zu einem Pharmabaustein sind bestimmte Zwischenschritte noch zu teuer, um am Markt erfolgreich zu sein, doch der Enzymwerkzeugkasten mit dem entsprechenden Potenzial sei nun vorhanden. „Das müsste man jetzt weiter ausbauen und optimieren“, sagt der Chemiker, „dafür reichen die vier Projektjahre nicht.“ Schließlich habe man zunächst eine Reihe von Problemen analysieren und lösen müssen. „Und dabei tauchen meist neue Probleme auf“, schmunzelt Fessner.
Analyse der Zusammenhänge zwischen Struktur und Funktion beim Enzym Aldolase
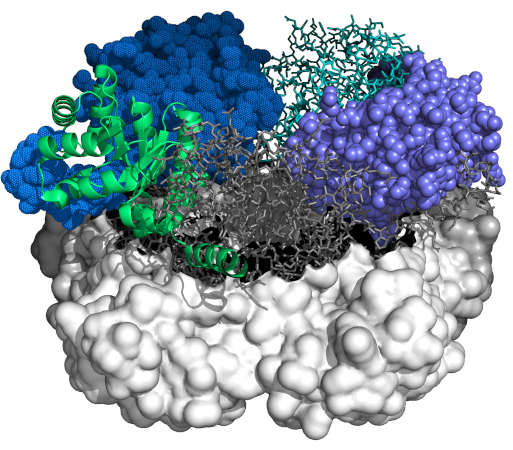
Synthesemöglichkeiten jenseits des Potenzials der Natur
„Für uns war eine wichtige Erkenntnis, dass die Enzymklasse der Aldolasen viel breiter nutzbar ist, als früher gedacht“, berichtet Fessner. „Wir können für hoch stereoselektive Reaktionen nicht nur Elektrophile, sondern auch Nukleophile verändern“, hebt der Projektleiter hervor. Letzteres habe man früher nicht für möglich gehalten. „Jetzt haben wir Katalysatoren für Synthesen, die es in der Natur nicht gibt.“ Außerdem konnten die Forscher wichtige Methoden verfeinern. Für zwei Patente, die aus dem Projekt entstanden sind, laufen derzeit Lizenzierungsgespräche.
„Für mich als Wissenschaftler war auch wertvoll zu sehen, dass man in so einem Konsortium modernste Technologien nutzen kann, auf die man als Einzelner keinen Zugriff hat – ob wegen des Geldes oder der Geräte. Dadurch kann man weit größere Räder drehen“, hebt Fessner hervor. Die Begleitung durch die Industrie habe zudem für das Projekt wertvolle Erkenntnisse geliefert.
Folgeprojekt bereits angelaufen
Die Ergebnisse haben auch das Bundesforschungsministerium überzeugt, das nun im EU-Programm ERA CoBioTech ein Folgeprojekt – Tralaminol – finanziert. Darin wollen die Forscher mit einem etwas kleineren Konsortium eine C-C-Kopplung mit einer Aminierung kombinieren und dafür neue Katalysatoren finden. Am Ende sollen komplexe Kaskadenprozesse als Ein-Topf-Reaktion durchführbar sein, denn das wäre ein wichtiger Vorteil für die industrielle Anwendung.
Autor: Björn Lohmann