Sie sitzen fest verankert am Meeresgrund. Auch die peitschende Brandung an den Küsten kann ihnen wenig anhaben – Miesmuscheln. Das Geheimnis ihrer Widerstandfähigkeit liegt in den Füßen: Die Schalentiere stellen dort ein Protein her, das unter Wasser so gut klebt wie kein anderes Material. Egal ob Stein, Metall oder Kunststoff, der Muschelkleber haftet enorm effizient auf den unterschiedlichsten Oberflächen.
Solch ein Klebstoff ist besonders in der Chirurgie und der Regenerativen Medizin ein gefragtes Werkzeug. Denn mit biokompatiblen Klebern könnten komplizierte Knochenbrüche rasch behandelt werden, anstatt sie aufwendig mit Schrauben, Nägeln oder Platten richten zu müssen. Aber auch Hautwunden und andere Gewebeverletzungen ließen sich mit einem solchen Nassklebstoff wieder verschließen.
Haftprotein-Gewinnung aus Muscheln zu aufwendig
Daher ist der Superkleber aus Muschelfußprotein schon seit Längerem ins Visier von Materialforschern und Medizinprodukteherstellern geraten. Allerdings ist es sehr aufwendig, das Haftprotein in größeren Mengen aus den Meerestieren zu gewinnen. Versuche, die Substanz chemisch zu synthetisieren, schlugen bisher fehl oder waren nicht wirtschaftlich. Eine weitere Herausforderung: Einmal zusammengerührt beginnt der Muschelkleber sofort zu kleben. Er ist dadurch schwer zu handhaben.
Im Rahmen eines Projektes aus der BMBF-Fördermaßnahme Ideenwettbewerb „Neue Produkte für die Bioökonomie“ entwickelt ein Team um Nediljko Budisa von der Technischen Universität Berlin ein biotechnologisches Verfahren, um den Superkleber in einer anwendungsfreundlicheren Form im Labor herzustellen.
Bakterien umprogrammiert
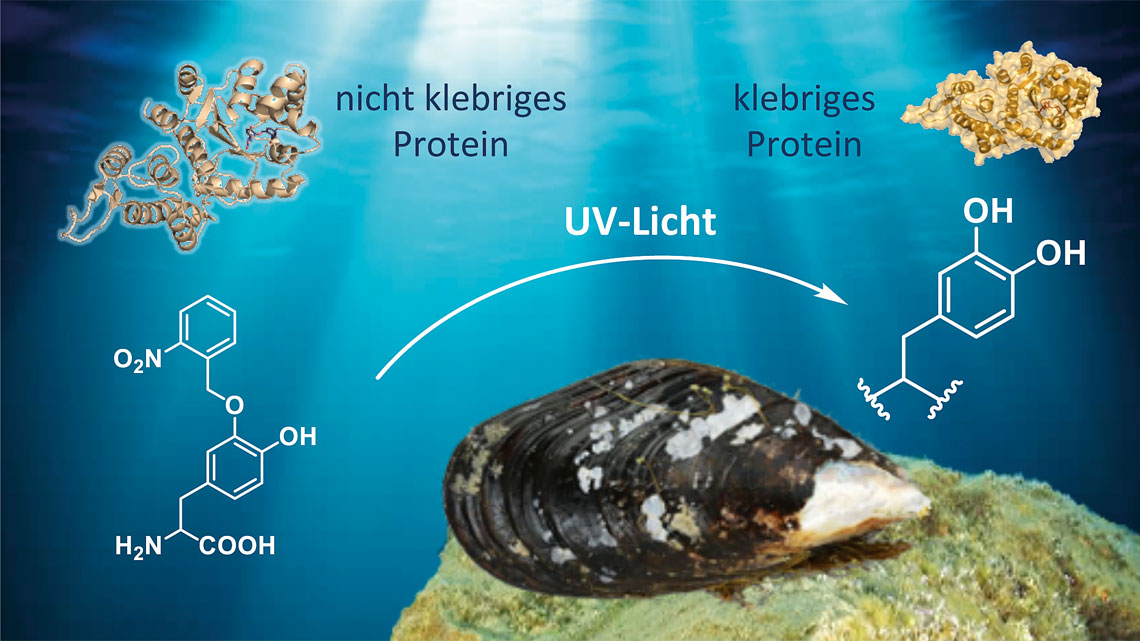
Dazu haben die Biotechnologen das Bakterium Escherichia coli so umfunktioniert, dass es fortan das Muschelfußprotein herstellen kann. Chemische Analysen haben offenbart: Die Aminosäure L-DOPA ist für die Superklebekraft des Leims verantwortlich. L-DOPA ist allerdings eine nicht-proteinogene Aminosäure – sie gehört von Natur aus nicht zum Repertoire der Proteinsynthese in der Zelle. In natürlichen Proteinen entsteht L-DOPA erst in nachgeschalteten Schritten durch einen biochemischen Prozess, der posttranslationale Modifikation genannt wird. L-DOPA ist allerdings auch sehr reaktiv, sodass das Protein von Anfang an überall kleben würde. Um dies zu vermeiden haben die Chemiker im Team noch die Schutzgruppe ortho-Nitrobenzol (oNB) an das L-DOPA gehängt.
Um die Bakterien zu Muschelproteinfabriken umzugestalten, die die nicht in der Natur vorkommende, sozusagen fremde (Xeno-) Aminosäure oNB-DOPA verwerten können, haben die Forscher den genetischen Code ihrer Organismen erweitert – eine Herangehensweise, die deshalb auch als Xenobiologie oder Synthetische Biologie bezeichnet wird.
Fortan können die Mikroben die Aminosäure direkt in ihrer Proteinsynthese verwenden. Der Clou: Da die Berliner Wissenschaftler die reaktive Catecholgruppe von L-DOPA mit der Schutzgruppe abgeschirmt haben, fungiert oNB-DOPA wie ein fotoaktivierbarer Schutzschalter. Erst wenn man das Muschelprotein mit UV-Licht bestrahlt, wird seine Klebeeigenschaft aktiviert. „Diese Schutzgruppe macht den Kleber überhaupt erst für die Praxis tauglich“, sagt Projektmitarbeiter Christian Schipp.
Förderung im Rahmen des Ideenwettbewerbs
Der Ideenwettbewerb „Neue Produkte für die Bioökonomie“ bietet Menschen mit originellen Produktideen für eine biobasierte Wirtschaft eine einfache Startförderung. Die Förderung erfolgt zweistufig. In der Sondierungsphase können Interessierte ihre Idee ausloten, einen Projektplan aufstellen und geeignete Partner suchen. In der etwa zweijährigen Machbarkeitsphase unterstützt das Bundesforschungsministerium die Projektpartner, damit aus der Idee tatsächlich ein Produkt oder eine Unternehmung werden kann.
„Ohne die BMBF-Förderung wäre unser ambitioniertes Projekt sicher nicht weitergegangen. Die Sondierungsphase bot uns die Möglichkeit, ein möglichst breites Konsortium für die Umsetzung unserer Idee zusammenzustellen“, sagt Schipp. Für die Machbarkeitsphase des XenoGlue-Projekts hat er ein Konsortium mit sechs Partnern zusammengestellt, damit aus der Idee bald ein marktreifes Medizinprodukt werden kann. Das BMBF unterstützt das Vorhaben in der Machbarkeitsphase mit insgesamt 1,2 Mio. Euro.
Produktionsprozess optimieren und klinische Tests
„Wir wollen bei der Produktionsmenge vom Milligramm- in den Grammbereich vorstoßen“, erläutert Schipp. Mit den Bioverfahrenstechnikern der TU Berlin und der Firma EloSystems GbR entwickelt das Xenoglue-Team Produktionsprozesse, die auch klinischen Qualitätsstandards genügen. Zudem wird der Nassklebstoff zur Behandlung oberflächlicher Wunden in der Tiermedizin erprobt. Der Partner Cellbricks GmbH entwickelt Hautmodelle, an denen die Biotechnologen die Klebekraft ihres Produkts ausgiebig testen können. Das Unternehmen Dendropharm wiederum entwickelt die richtige Zusammensetzung des Muschelklebers und testet ihn dann an Kleintieren. Überzeugt der Kleber hier, wollen die Biotechnologen auch erste klinische Studien starten und ein Unternehmen namens „XenoGlue“ gründen.
Erste Schritte auf diesem Weg hat das Team um Schipp bereits gemeistert. Im vergangenen Jahr zählten die Berliner zu den Gewinnern des Science4Life-Businessplan-Wettbewerbs. Auch die Initiative „Deutschland – Land der Ideen“ ist auf das Projekt aufmerksam geworden. 2018 wurde das Projektteam als ausgezeichneter Ort im Land der Ideen prämiert.
Autor: Philipp Graf


