
Lassen sich zwei Herstellungsverfahren zu einem einzigen und zugleich nachhaltigeren Prozess verbinden? Mit dieser Fragestellung ist das Projekt Linopol vor vier Jahren angetreten. Auf der einen Seite wollten die Beteiligten um Projektleiter Ulrich Schörken von der TH Köln die bislang erdölbasierte Herstellung von Polyamid 12 durch eine biobasierte Alternative ersetzen. Zum anderen sollten Abfallprodukte in der Duft- und Aromastoffherstellung vermieden und in Wertstoffe verwandelt werden. Im vergangenen Jahr gelang dem Team der Machbarkeitsnachweis.
Duftstoff und Kunststoff in einem Verfahren
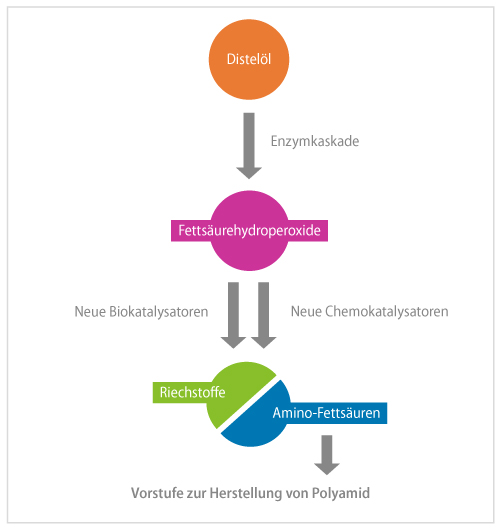
In der Duftstoffherstellung wird Linolsäure gespalten, um Hexanal zu gewinnen. Der kleinere Teil mit sechs Kohlenstoffatomen ist der Duftstoff. Der größere, auf zwölf Kohlenstoffatomen basierende Teil wird jedoch entsorgt. „Wir haben uns gefragt: Können wir nicht die ganze Fettsäure nutzen?“, erinnert sich Schörken an die Entstehung der Projektidee. Das größere Spaltprodukt könnte schließlich Ausgangsverbindung für Polymere wie den Kunststoff Polyamid sein, aus dem etwa Nylon besteht. Das überzeugte auch das Bundesforschungsministerium, das das Vorhaben von März 2019 bis Juli 2022 mit 538.000 Euro förderte, als Teil des Förderprogramms „Technologie-Initiative Bioraffinerien“ im Rahmen der „Nationalen Forschungsstrategie BioÖkonomie 2030“.
Als Ausgangsmaterial setzte das Team auf Disteln als Quelle für die Linolsäure. Disteln sind als einheimische Pflanzen, die auch auf mageren Böden wachsen, eine attraktive Art für neue bioökonomische Nutzungen. Dabei verfolgten die Forschenden zwei Ansätze parallel: die Synthese mittels Enzymen und die Chemokatalyse.
Geeignete Enzyme für den biotechnologischen Prozess gesucht
Für den biotechnologischen Weg mussten die Projektbeteiligten zunächst die geeigneten Enzyme identifizieren. Eine Lipoxygenase sollte im ersten Schritt die Linolsäure peroxidieren. Dabei stellte sich heraus, dass etwa käufliche Lipoxygenase aus Soja besser funktioniert als die rekombinant, sprich biotechnologisch selbst erzeugten Enzyme. Im zweiten Schritt würde eine Hydroperoxid-Lyase das Zwischenprodukt zur Oxocarbonsäure umwandeln. Hydroperoxid-Lyasen sind so empfindlich, dass es sie nicht im Handel gibt und die Forschenden sie selbst herstellen mussten. Die vielversprechendsten Ergebnisse wurden mit einer neuen Hydroperoxid-Lyase aus Papaya erzielt, die rekombinant in E. coli produziert wurde. Schließlich erzeugt eine Transaminase daraus die Aminocarbonsäure – den Polyamidbaustein. Einige Omega-Transaminasen sind in der Literatur beschrieben, die langkettige hydrophobe Substrate umsetzen können. So fand das Forschungsteam gleich sieben verschiedene Enzyme, die es erfolgreich ausprobierte.
Insbesondere die Hydroperoxidlyase erwies sich als Flaschenhals. „Das Enzym ist schwer herstellbar, sehr empfindlich und sowohl substrat- als auch produktinhibiert“, berichtet Schörken. Zudem sind die erzeugten Oxosäuren sehr reaktiv. „Die Substanzen verschwinden daher schnell und wir hatten anfangs Probleme, unsere Produkte zu identifizieren“, erinnert sich der Projektleiter. Die dritte Herausforderung bestand darin, dass das Endprodukt der Enzymkaskade, die 12-Amino-Oxododecensäure, sowohl zwitterionisch als auch hydrophob ist und sich weder in wässriger Lösung noch in organischen Lösungsmitteln leicht extrahieren lässt.
Konti-Verfahren barg als Vier-Phasen-System zu große Schwierigkeiten
Um einige dieser Probleme zu lösen, hatte das Team zeitweise versucht, anstelle des als Batchverfahren konzipierten Prozesses einen kontinuierlichen Prozess zu verwenden, bei dem die Enzyme in einer Reaktorsäule immobilisiert sind. „Darin hatten wir dann aber eine wässrige Phase, eine Lipidphase, eine Gasphase und die Feststoffphase mit den Enzymen“, sagt Schörken. „So ein Vier-Phasen-System braucht sehr viel Optimierung.“ Außerdem bereitete die Sauerstoffsättigung Probleme. Am Ende blieb es daher beim ursprünglichen Ansatz.
Trotzdem verlief das Projekt sehr erfolgreich: „Wir konnten nach etwas mehr als zwei Jahren zum ersten Mal nachweisen, dass die komplette Kaskade funktioniert und wir so einen bifunktionalen Baustein für die Polyamid-12-Synthese hinbekommen können“, freut sich der Projektleiter. Ob es in den drei Jahren des Projekts wirklich gelinge würde, diesen Machbarkeitsnachweis zu erbringen, war anfangs keineswegs sicher.
Erfolgreicher chemischer Ansatz mit neuen Katalysatoren
Unerwartet erfolgreich verlief auch der chemische Ansatz. Den erprobte das Team zunächst in der eng verwandten Synthese von Phenol. Bislang setzt die Branche dabei vor allem auf sogenannte Lewis-Säuren als Katalysatoren. Die Forschenden an der TH Köln konnten jedoch zeigen, dass auch heterogene Katalysatoren geeignet sind – so gut geeignet, dass dieses Verfahren patentiert wurde. Die gleichen Katalysatoren ließen sich schließlich nutzen, um Hydroperoxide auf dem Weg zum Polyamid zu spalten. Für eine industrielle Anwendung sind natürlich noch weitere Optimierungen erforderlich.
Schörken ist trotzdem nicht unzufrieden, denn alle Projektziele wurden erreicht. Mit der Phenolsynthese fiel ein unerwartetes Nebenprodukt ab. Auch die im Projekt genutzten Transaminasen sind so leistungsfähig, dass der Forscher in anderen Projekten mit ihnen weiterarbeiten möchte. Nicht zuletzt konnten drei Projektmitarbeitende darin promovieren und sieben wissenschaftliche Publikationen veröffentlichen. Oder wie der Projektleiter es zusammenfasst: „Wissenschaftlich war das Projekt ein großer Erfolg.“
Autor: Björn Lohmann


