Was sind mikrobielle Zellfabriken?
Der Mensch bedient sich schon seit Tausenden von Jahren der enorm vielfältigen Stoffwechselleistungen von Mikroorganismen. So sind Bakterien, Hefen und Schimmelpilze unverzichtbare Helfer für die Herstellung von Brot, Käse, Milchprodukten, Wein, Essig oder Bier. Als Meister der Stoffumwandlung arbeiten Mikroorganismen wie winzige Chemiefabriken. Meistens werden sie mit Substraten aus nachwachsenden Rohstoffen „gefüttert“. Sie setzen diese Nahrung mithilfe ihres spezifischen Stoffwechsels um und stellen daraus neue Substanzen her. Die Werkzeugkiste der Natur in technischen Anwendungen zu nutzen, um damit interessante Substanzen oder maßgeschneiderte Produkte herzustellen – das ist ein zentrales Ziel der Biotechnologie.
Erkenntnisse aus der Zell- und Molekularbiologie sowie die Entwicklung biotechnologischer Werkzeuge haben neue Möglichkeiten eröffnet, die mikrobiellen Stoffwechselleistungen zu erforschen, die Zellen mit neuen Eigenschaften auszustatten und so gezielt für die biotechnologische Produktion zu nutzen. Ob in der Chemie, Pharma- oder Lebensmittelindustrie – seit Jahrzehnten werden Zellen als Biofabriken in vielfältiger Weise eingesetzt, um Chemikalien, Medikamente, Impfstoffe oder Treibstoffe herzustellen. Die industrielle Anwendung von Mikroorganismen, Zellen oder Enzymen für verschiedenste Branchen wird industrielle oder weiße Biotechnologie genannt.
Mikrobielle Produktion im großen Maßstab
Mikrobielle Produktionsprozesse haben mehrere Vorteile: Sie laufen zumeist in wässrigen Lösungen, bei Zimmertemperatur und unter Normaldruck ab. Damit hilft der Einsatz von mikrobiellen Produzenten im Vergleich zu den meisten chemisch-synthetischen Prozessen, Ressourcen und die Umwelt zu schonen.
Zudem lassen sich Substanzen gewinnen, die mit klassischen chemischen Methoden nur schwer zu produzieren sind, zum Beispiel Proteine wie Enzyme, Hormone und Antikörper. Es handelt sich um derart komplexe und große Biomoleküle, dass man sie nicht chemisch nachbauen kann. Sie müssen durch Biosynthese in lebenden Zellen hergestellt werden. Zudem können Mikroorganismen die gewünschten Produkte in großer Reinheit liefern, was vor allem bei Medikamenten eine bedeutende Rolle spielt.
Der biotechnologische Prozess, in dem Mikroorganismen oder andere Kulturzellen biologische Produkte herstellen, wird von Fachleuten als Fermentation bezeichnet. Für die industrielle Produktion werden bisher nur wenige Dutzend optimierte Produktionsorganismen genutzt. Diese Zellfabriken sind Hochleistungsproduzenten.
Sie zeichnet aus, dass sie sich sehr schnell vermehren und dass sie meist kostengünstig in großen Bioreaktoren (den Fermentern) zu kultivieren sind. Sie sind robust und genetisch stabil, leicht zu handhaben und stellen ein gewünschtes Produkt zuverlässig in hoher Ausbeute her. Noch dazu sind Zellfabriken molekularbiologisch gut erforscht und es existieren viele Werkzeuge, mit denen sich die winzigen Leistungsträger auf Höchstleistung trimmen lassen, um ihre Produkte konstant und mit gleichbleibender Qualität abzuliefern.

Seite 2 von 14
Leistungsfähige Zellfabriken entwickeln
Einige mikrobielle Zellfabriken wie der Schimmelpilz Aspergillus niger sind bereits seit mehr als einhundert Jahren im Industrie-Einsatz. Forschende in der Biotechnologie sind beständig auf der Suche nach Mikroben mit neuen, interessanten Fähigkeiten. Ein wichtiger Fundus sind neben Umweltproben sogenannte Stammsammlungen oder Genbanken, die mithilfe von speziellen Testverfahren nach neuen Eigenschaften durchsucht werden können. Auch die Fortschritte in der Genomforschung helfen, die enorme natürliche Vielfalt zu erschließen.
Ist ein interessanter Mikroorganismus identifiziert, so wird er im Labor kultiviert und für den Einsatz in biotechnologischen Produktionsprozessen optimiert. Dazu durchlaufen die Kandidaten eine sogenannte Stammentwicklung: Mithilfe molekularbiologischer Verfahren wird ihr Stoffwechsel so umgestaltet, dass die Mikroben gewünschte Produkte in hohen Mengen herstellen, aber die Bildung unerwünschter Nebenprodukte verhindert wird.
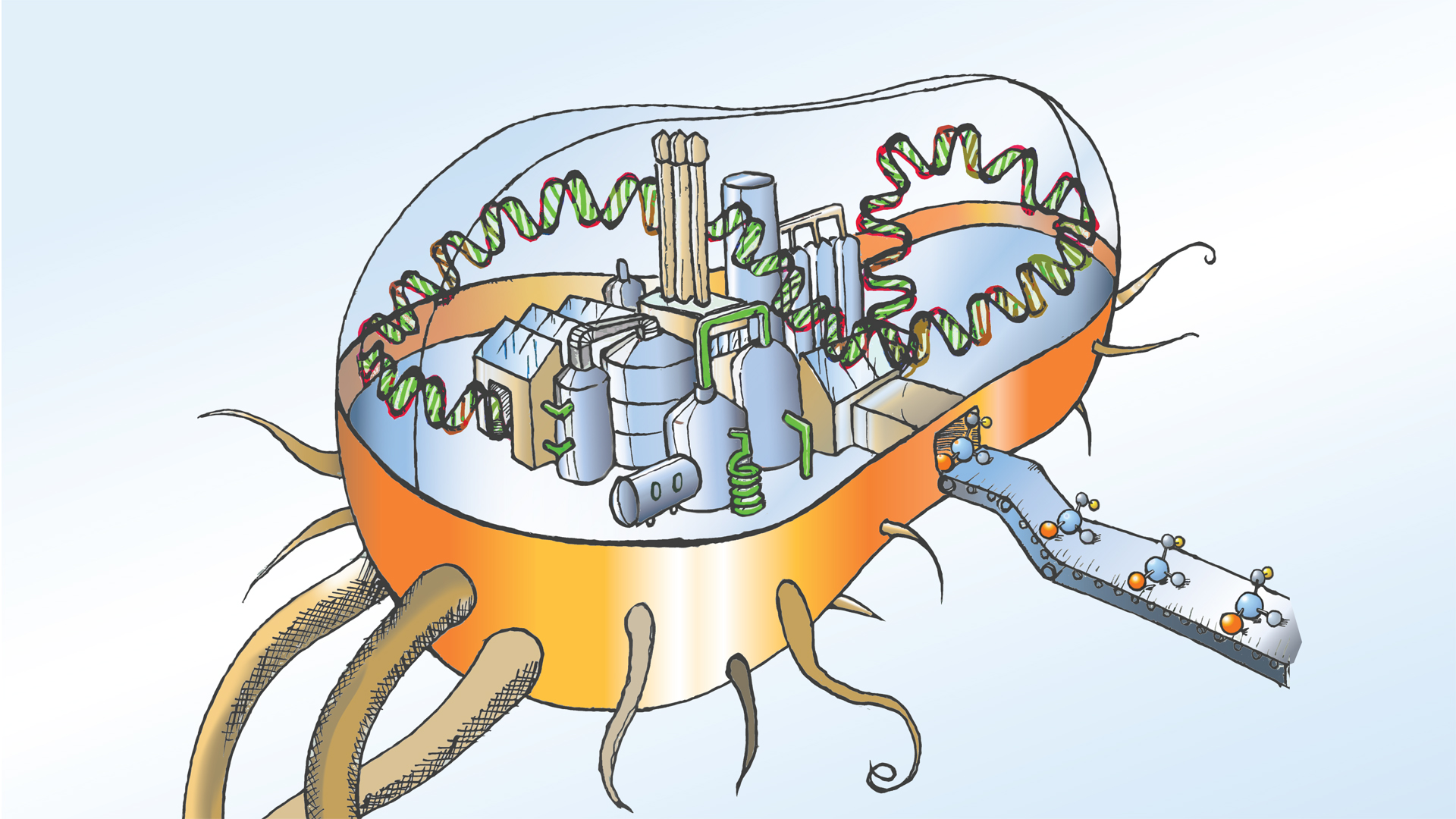
Klassischerweise werden Mikroorganismen, die Mutationen in ihrem Erbgut tragen und interessante Eigenschaften aufweisen, ausgewählt und im Labor immer weiter gezüchtet, bis ihre Stoffwechselleistungen optimal an den technischen Produktionsprozess angepasst sind. Seit den 1980er Jahren haben gentechnische Methoden Einzug gehalten. So lässt sich zum Beispiel der molekulare Bauplan eines gewünschten Enzyms in Bakterien einschleusen. Auf diese Weise werden die Zellen umfunktioniert und darauf programmiert, fortan das hinzugefügte Enzym in hoher Ausbeute und Reinheit herzustellen.
Die Anpassung der Mikroorganismen geht so weit, dass komplette Stoffwechselwege gezielt verändert, umgebaut oder sogar völlig neu konstruiert werden – die Fachwelt spricht vom Metabolic Engineering. Dieser Ansatz zählt zur Synthetischen Biologie, deren Ziel es ist, biologische Systeme modulartig zu entwerfen und zu konstruieren. In den vergangenen Jahren sind viele neue Werkzeuge entstanden, die den Forschenden dabei helfen, Produktionsorganismen mit besonderen Eigenschaften zu entwickeln. Hier spielen systembiologische Ansätze und bioinformatische Werkzeuge eine wichtige Rolle ebenso wie die Genom-Editierung und Technologien der Bioverfahrenstechnik.
Seite 3 von 14
Die Leistungsträger der Biotech-Industrie im Steckbrief-Format
Zu den wichtigsten Produktionsorganismen der Biotech-Industrie gehören Bakterienarten wie Escherichia coli, die Bäckerhefe Saccharomyces cerevisiae oder der Schimmelpilz Aspergillus niger. Diese und weitere bewährte Leistungsträger aus dem Mikrokosmos werden in den folgenden Kapiteln in kompakten Steckbriefen vorgestellt.
Das Autorenteam von bioökonomie.de hat für dieses Themendossier führende Fachleute aus der Mikrobiologie und Biotechnologie in Deutschland gebeten, die Steckbriefe zu lesen und die zusammengestellten Fakten zu überprüfen. Einige haben uns auch Fotos zur Verfügung gestellt. Wir bezeichnen die Expertinnen und Experten daher als Steckbriefpaten.
Seite 4 von 14
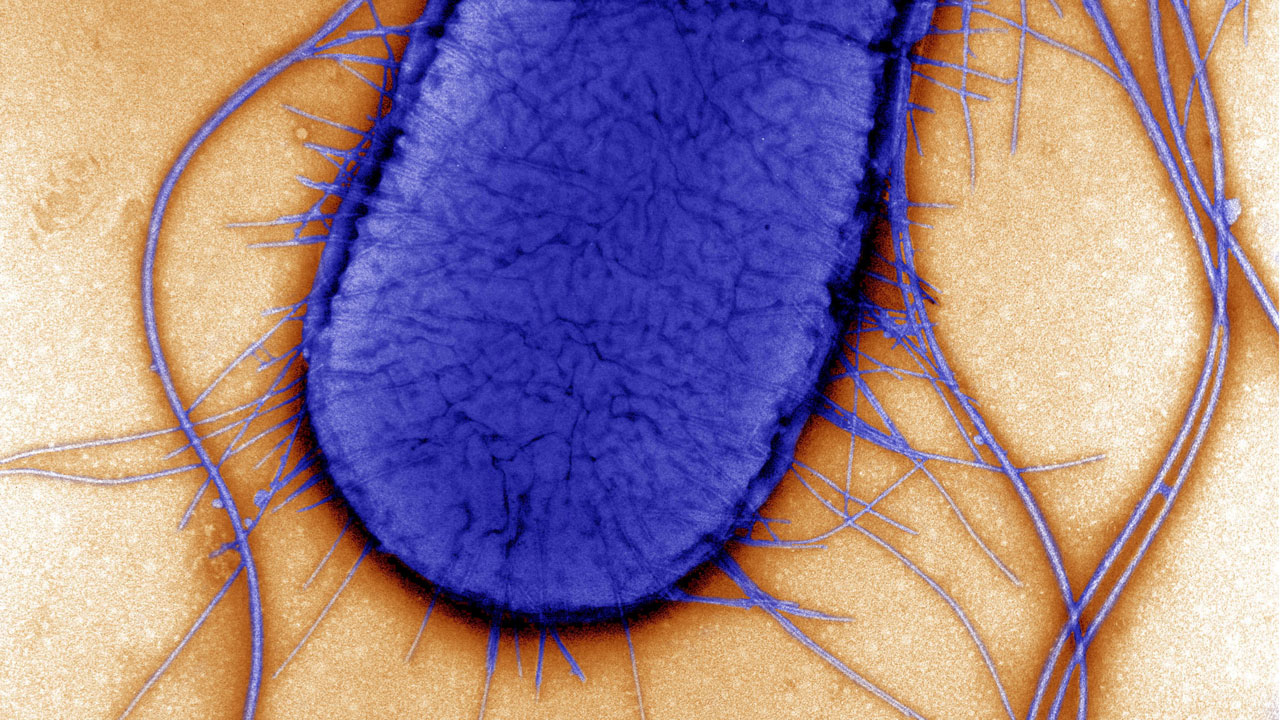
Escherichia coli – gut erforschtes Arbeitstier
Merkmale: Escherichia coli ist das besterforschte und bekannteste Bakterium der Welt. Die begeißelten und stäbchenförmigen Mikroben leben im Darm von Säugetieren und Vögeln. E. coli ist ein gramnegatives Bakterium, es besitzt neben der Cytoplasma-Membran noch eine zweite äußere Membran. Das ringförmige Genom das Stamms K12 ist ca. 4,6 Millionen Basenpaare groß und enthält etwa 4.500 Gene. Es wurde 1997 als eines der ersten Genome komplett sequenziert. Coli-Bakterien wachsen sehr schnell: Die Generationszeit – also die Dauer zwischen zwei Zellteilungen – beträgt unter optimalen aeroben Wachstumsbedingungen bei 37 Grad Celsius ca. 20 Minuten. E. coli ist fakultativ anaerob, das heißt es kann auch ohne Sauerstoff leben. Weil das Bakterium leicht genetisch zu verändern und im Labor gut zu handhaben ist, gilt es als der molekularbiologische Modellorganismus schlechthin. In der Regel wird der Stamm E. coli K12 verwendet, der die menschliche Gesundheit nicht gefährden kann.
Einsatzfelder: In der Biotechnologie wird E. coli als zuverlässiges und vielseitig einsetzbares „Arbeitstier“ geschätzt. Es ist eine wichtige Plattform für molekularbiologische Experimente und kann in kostengünstigen Medien kultiviert werden. In der Biotech-Industrie wird E. coli vor allem für die Produktion von nicht-glykosylierten Proteinen genutzt, das heißt für Eiweißmoleküle ohne Zuckerstrukturen auf ihrer Oberfläche. Je nach verwendetem System sammeln die Zellen die erzeugten Proteine entweder im Zellinneren an oder sie geben sie in den Raum zwischen den beiden Membranen ab. Auch für die Grundlagenforschung in der Protein-Strukturbiologie kommt dem Bakterium eine zentrale Bedeutung zu.
Produkte: Ein prominentes Beispiel ist Humaninsulin, das als erstes gentechnisch hergestelltes Pharmaprodukt bereits in den 1980er Jahren kommerzialisiert wurde. 2018 hatte der globale Markt für Humaninsulin ein Volumen von rund 20 Mrd. Euro, bis 2026 soll er auf rund 25 Mrd. Euro anwachsen. Ein weiteres wichtiges therapeutisches Produkt ist das Wachstumshormon Somatropin. E. coli ist zudem Zellfabrik zur Herstellung zahlreicher Feinchemikalien, Enzyme und Arzneistoffe, darunter moderne und kostengünstige Impfstoffe, Vitamine, Aminosäuren und Proteine. Ein Meilenstein des Metabolic Engineering ist die kommerzielle Herstellung von 1,3-Propandiol mit E. coli.
Produktive Verwandte: Neben E. coli K12 und davon abgeleiteten Stämmen werden einige weitere E. coli-Stämme industriell gerne genutzt. E. coli W-Stämme wachsen sehr gut auf dem Rüben- oder Rohrzucker Saccharose und können so günstige Substrate wie Melassen als Kohlenstoffquelle verwenden.
Steckbriefpate: Prof. Dr. Lars Blank (RWTH Aachen)
Seite 5 von 14
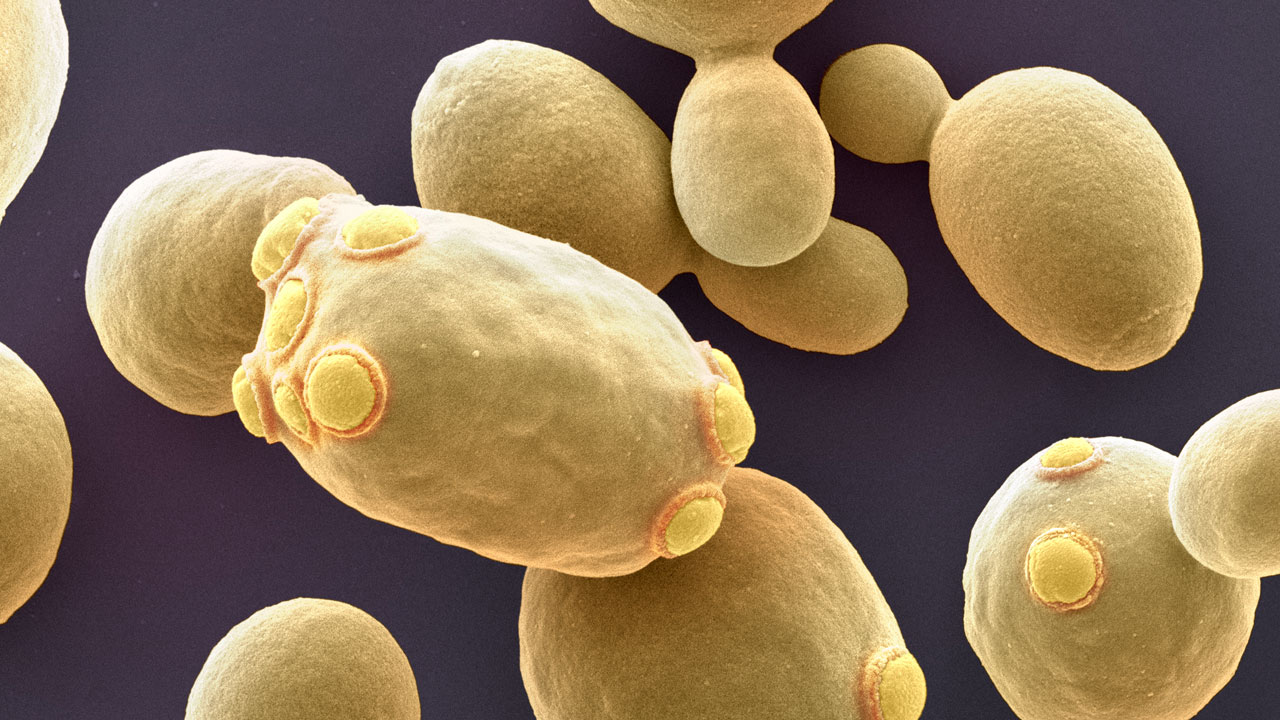
Bäckerhefe Saccharomyces cerevisiae – ergiebiger Allrounder
Merkmale: Backhefe, Bäckerhefe oder Bierhefe – Saccharomyces cerevisiae ist wahrscheinlich der bekannteste einzellige Pilz der Welt. Der Mensch nutzte seine Dienste, um alkoholische Getränke herzustellen, noch bevor er etwas von der Existenz von Mikroorganismen ahnte. Die Zellen der Hefe sind rund bis oval, messen fünf bis zehn Mikrometer. Die Bäckerhefe ernährt sich fast ausschließlich von Einfach- und Zweifachzuckern und sondert Kohlendioxid sowie Alkohol ab. Sie vermehrt sich durch Knospung, idealerweise bei 28 Grad Celsius. S. cerevisiae ist fakultativ anaerob, kann also auch ohne Sauerstoff wachsen. Die Bäckerhefe war der erste eukaryotische Organismus, dessen Genom sequenziert wurde. Es besteht aus 16 Chromosomen, die insgesamt 13 Millionen Basenpaare und etwa 6.275 Gene umfassen. Die Generationsdauer beträgt bei aerobem Wachstum zwei Stunden, anaerob verläuft die Verdoppelung langsamer.
Einsatzfelder: Ihre gute Kultivierbarkeit im Labor und die riesige Palette genetischer Werkzeuge sichern S. cerevisiae einen festen Platz als Modellorganismus in der molekularbiologischen Forschung. Hefezellen als Biomasse werden für die Backindustrie und als Lebens- und Futtermittelzusatz (zum Beispiel Trockenhefe) produziert. Da die Hefe Zucker in Alkohol umsetzt, wird sie seit Jahrtausenden genutzt, um mittels Gärung alkoholische Getränke, insbesondere Bier und Wein, herzustellen. In jüngerer Vergangenheit spielt diese Eigenschaft zudem eine Rolle bei der Erzeugung von Bioethanol als Flüssigtreibstoff.
Produkte: Weltweit wurden 2018 rund 1,9 Milliarden Hektoliter Bier pro Jahr mittels Hefen der Gattung Saccharomyces produziert. Die Weinproduktion lag im selben Jahr bei 292 Millionen Hektolitern. Auch an der Produktion von Cider und Essig ist S. cerevisiae beteiligt. Die weltweite Produktion von Bioethanol für Kraftstoffe betrug 2018 128 Millionen Kubikmeter. Auch technische Enzyme, Feinchemikalien und pharmazeutische Wirkstoffe, darunter Geruchstoffe wie Patschuliöl, Insulin oder das Malaria-Medikament Artemisinin.
Produktive Verwandte: Während zum Backen praktisch immer S. cerevisiae genutzt wird, kommen in der Alkoholfermentation auch andere Saccharomyces-Stämme zum Einsatz, darunter sogenannte Reinzuchthefen, die reproduzierbare Aromen garantieren, sowie die in der Weinerzeugung verbreiteten Stämme S. bayanus, S. ellipsoides und S. uvarum. Die Hefen Pichia pastoris und Hansenula polymorpha sind methylotroph, das heißt sie können auf Methanol als einziger Kohlenstoff-Quelle wachsen. Sie haben sich als effiziente Produktionsorganismen für rekombinante Proteine wie Enzyme oder Antikörper erwiesen.
Steckbriefpate: Dr. Stefan Jennewein (Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME, Aachen)
Seite 6 von 14
Bacillus subtilis – zuverlässiger Enzym-Lieferant
Merkmale: Der als Heubazillus bekannte Bacillus subtilis ist ein Bodenbakterium, das sich leicht in einem Heuaufguss entdecken lässt. Es kann sowohl aerob als auch anaerob wachsen. Das Bakterium ist zwei bis drei Mikrometer lang, stäbchenförmig und begeißelt. Unter ungünstigen Wachstumsbedingungen überdauert es in Form widerstandsfähiger Sporen. Sie sind äußerst hitzetolerant. Sein etwa 4,2 Millionen Basenpaare und 4.100 Gene umfassendes Genom war 1997 das erste sequenzierte eines grampositiven Bakteriums. Der Stoffwechsel des Bakteriums erzeugt eine Reihe interessanter Chemikalien, weshalb es schon früh in den Blick der Biotechnologie geraten ist. Bei optimalen Bedingungen, darunter eine Temperatur von 40 Grad Celsius, beträgt seine Generationszeit 26 Minuten. Die weit verbreitete Mikrobe ernährt sich von Zuckern sowie von Stoffwechselprodukten anderer Organismen. Außerdem kann B. subtilis extrazelluläre Fremd-DNA aufnehmen und ins eigene Genom integrieren, was als Kompetenz bezeichnet wird.

Einsatzfelder: Weil B. subtilis sehr selten humanpathogen ist, besitzen viele seiner Produkte den GRAS-Status (generally recognized as safe) der US-Behörde FDA. Zudem ermöglichte seine natürliche Kompetenz schon in den 1960er Jahren eine Kartierung seiner Gene. Heute ist B. subtilis daher ein wichtiger genetischer Modellorganismus.
Hinzu kommt ein umfangreiches Interesse der Industrie. Die Mikrobe erzeugt zahlreiche interessante Enzyme und gibt sie in das Nährmedium ab, aus dem sie dann leicht aufgereinigt werden können. Zudem stellt B. subtilis Vitamine und Antibiotika her. In der Landwirtschaft wird B. subtilis als biologisches Fungizid genutzt, um Samen und somit die junge Pflanze zu besiedeln und vor Pilzbefall zu schützen. In Asien dient das Bakterium außerdem dazu, bestimmte Lebensmittel zu fermentieren. In früheren Jahren – vor der Entwicklung von Antibiotika – kam der Mikroorganismus auch als Therapeutikum bei Haut-und Darmerkrankungen zum Einsatz. Davon ist die Medizin heute abgerückt.
Produkte: Das Bakterium dient der biotechnologischen Herstellung des dermatologischen Antibiotikums Bacitracin und des Vitamins B2 (Riboflavin). Die Jahresproduktion von mikrobiell fermentiertem Riboflavin liegt bei rund 10.000 Tonnen, allerdings sind daran weitere Mikroorganismen beteiligt. B. subtilis produziert außerdem eine Reihe extrazellulärer Enzyme, die meist in Waschmitteln verwendet werden, darunter Proteasen, Amylasen, Cellulasen und Lipasen. Zu den mittels B. subtilis fermentierten Lebensmitteln gehören das japanische Nattō und das koreanische Cheonggukjang, die beide auf Soja basieren. Die Methode ist im gesamten südostasiatischen Raum, aber auch bei westafrikanischen Bohnenprodukten verbreitet.
Produktive Verwandte: Der in der Lebensmittelherstellung genutzte Mikroorganismus wurde früher als eigene Art eingestuft und hieß B. natto. Heute gilt er als Stamm von B. subtilis. Diverse Bacillus-Arten, darunter B. licheniformis, B. clausii und B. halodurans, bilden gemeinsam die wichtigsten Zellfabriken für die Enzymgruppe der Proteasen, deren gesamtes Marktvolumen auf rund 2 Mrd. Euro pro Jahr geschätzt wird und bis 2024 auf 2,8 Mrd. Euro anwachsen soll.
Steckbriefpaten: Prof. Dr. Christoph Wittmann (Universität des Saarlandes); Prof. Dr. Jörg Stülke (Universität Göttingen)
Seite 7 von 14
Corynebacterium glutamicum – vom Aminosäure-Spezialisten zum Multitalent
Merkmale: Corynebacterium glutamicum ist ein stäbchenförmiges, grampositives, nicht-pathogenes Bodenbakterium von etwa 2 Mikrometern Länge, das seit mehr als 60 Jahren industriell genutzt wird. Sein Erbgut umfasst mehr als 3.000 Gene, die für ein vielseitiges Repertoire an Stoffwechselleistungen codieren und dem Bakterium eine flexible Anpassung an verschiedene Umweltbedingungen ermöglichen. Da C. glutamicum ein ungefährliches Bakterium ist, wird vielen seiner Produkte der GRAS-Status (generally recognized as safe) der US-Behörde FDA verliehen.
Einsatzfelder: Im Jahr 1957 entdeckte ein japanisches Forscherteam das Bakterium und stieß auf seine außergewöhnliche Fähigkeit, unter speziellen Bedingungen den Geschmacksverstärker L-Glutamat zu produzieren. Seitdem wurde die Mikrobe zum Plattformorganismus der industriellen Biotechnologie weiterentwickelt, der unter aeroben Bedingungen viele natürliche Aminosäuren im Überschuss herstellen kann. Da das Bakterium unter Zuckermolekülen als „Futter“ sowohl Pentosen als auch Hexosen verwerten und neben Aminosäuren mittlerweile mehr als 70 verschiedene industriell benötigte Chemikalien herstellen kann, ist es von besonderem Interesse für den Einsatz in Bioraffinerien. Darüber hinaus dient C. glutamicum als nicht-pathogener Modellorganismus der Erforschung verwandter pathogener Bakterien.
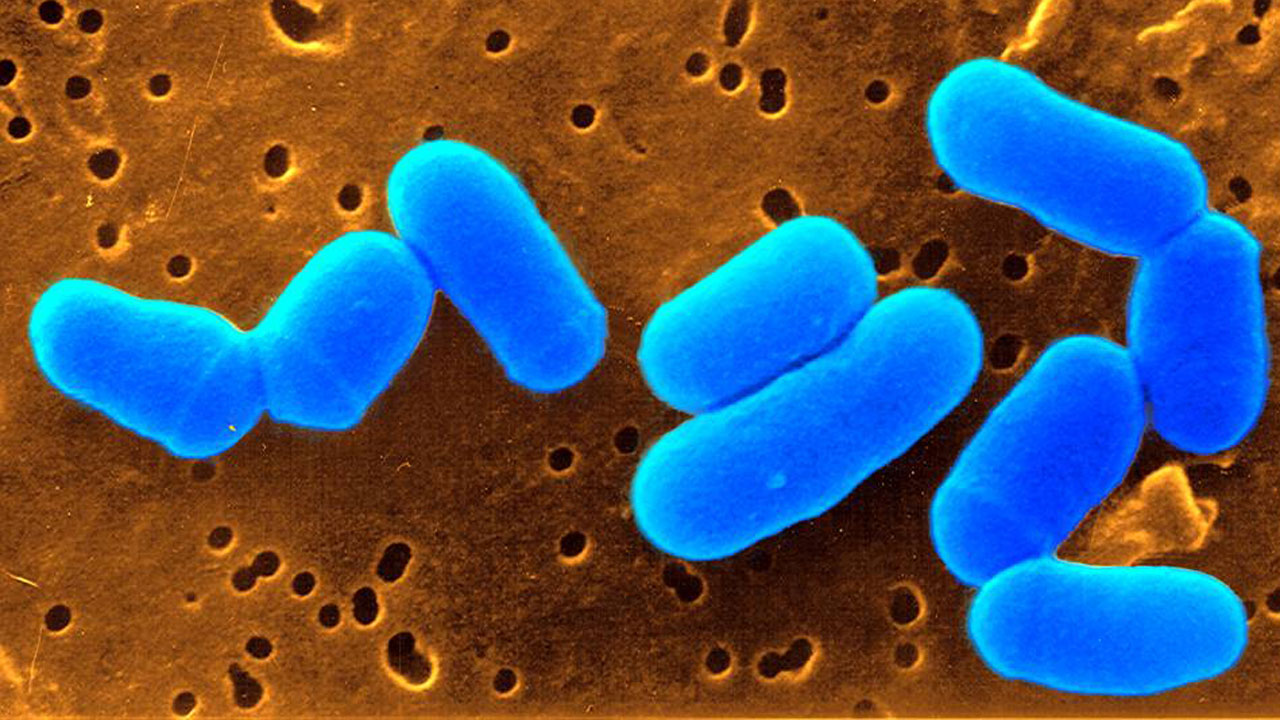
Produkte: Mehr als 3 Millionen Tonnen L-Glutamat und mehr als 2 Millionen Tonnen L-Lysin werden derzeit jedes Jahr mittels C. glutamicum hergestellt. Diese Aminosäuren werden in der Lebens- und Futtermittelindustrie eingesetzt. Aber auch viele andere natürliche Aminosäuren werden heute in großer Menge durch das Bakterium produziert. Zur Produktpalette zählen außerdem organische Säuren wie Bernsteinsäure, diverse Alkohole und Diamine als Bausteine für Biokunststoffe, Vitamine wie Pantothenat für die Ernährung, hochpreisige natürliche Zusatzstoffe für Kosmetik und Medizin sowie eine Reihe von Proteinen und Nukleotiden.
Produktive Verwandte: Corynebacterium ammoniagenes wird genutzt, um die Nukleotide Inosinmonophosphat (IMP) und Guanosinmonophosphat (GMP) herzustellen. Diese können die geschmacksverstärkende Wirkung von L-Glutamat noch erhöhen.
Steckbriefpaten: Prof. Dr. Michael Bott (Forschungszentrum Jülich); Prof. Dr. Christoph Wittmann (Universität des Saarlandes)
Seite 8 von 14
Schimmelpilz Aspergillus niger – robuste Zitronensäure-Quelle
Merkmale: Wer schon einmal verschimmeltes Obst oder Gemüse gesehen hat, ist vermutlich auch Aspergillus niger begegnet, dem Schwarzen Gießkannenschimmel. Seinen Namen hat der fadenförmige Pilz von den fast schwarzen Sporen, die er bildet. Aspergillus niger ist sehr robust und anspruchslos: Am wohlsten fühlt er sich bei 35 bis 37 Grad Celsius, kann aber zwischen 6 und 47 Grad Celsius wachsen. Auch gegenüber Säure weist er eine hohe Toleranz auf und wächst bei einem pH-Wert zwischen 1,5 und 9,8. Der widerstandsfähige Schlauchpilz ist eine der wenigen Spezies, die selbst auf der Internationalen Raumstation ISS problemlos gedeihen. Das im Jahr 2007 sequenzierte Genom umfasst 34 Millionen Basenpaare, verteilt auf acht Chromosomen. Anders als viele Aspergillus-Arten geht von A. niger nur eine geringe Gesundheitsgefahr für Menschen aus – auch er besitzt den GRAS-Status der US-Behörde FDA.
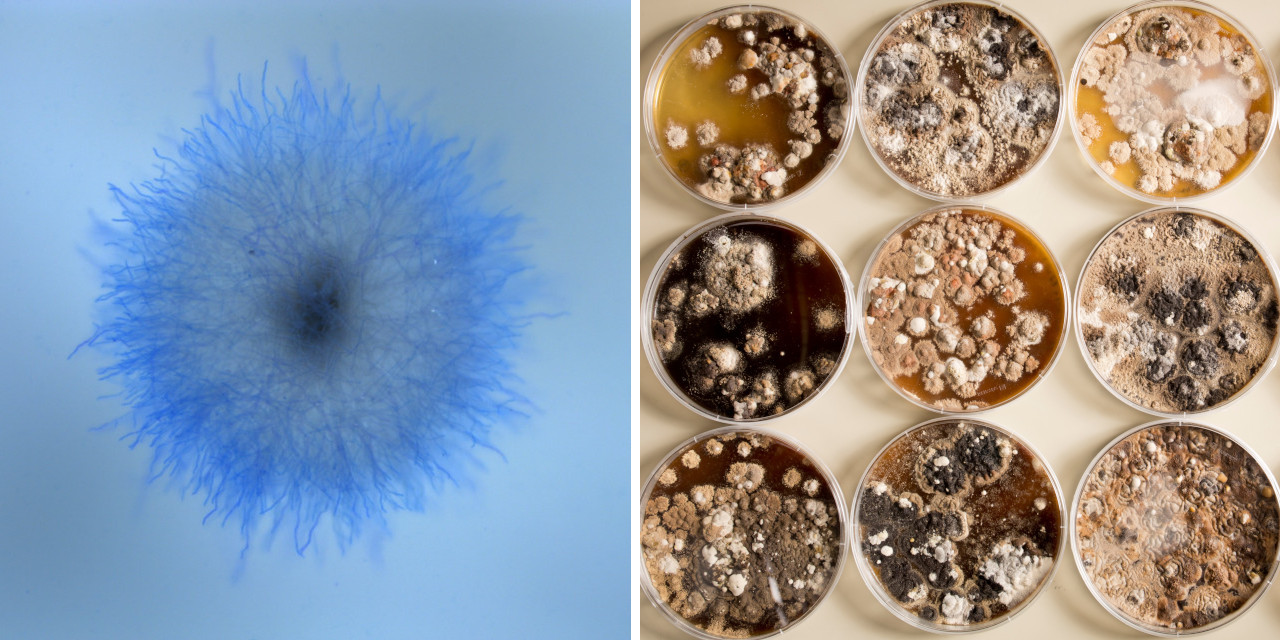
Einsatzfelder: In der Grundlagenforschung dient A. niger als molekulargenetischer Modellorganismus. Die Biotech-Industrie nutzt den Pilz primär als Zellfabrik für organische Säuren sowie eine große Vielfalt an Enzymen. Diese Produkte scheidet der Pilz ins Nährmedium aus. Bereits im Jahr 1919 wurde A. niger vom US-Unternehmen Pfizer erstmals für die Produktion von Zitronensäure im großen Maßstab eingesetzt, ein früher Meilenstein der industriellen Biotechnologie. Darüber hinaus kann der Schimmelpilz Cyano-Metall-Komplexe bilden und auf diese Weise aus Abwässern des Erzabbaus Gold, Silber oder andere Schwermetalle herausfiltern.
Produkte: Die wichtigste Chemikalie, die mit Aspergillus niger als Zellfabrik hergestellt wird, ist Zitronensäure. Sie wird in der Lebensmittelindustrie als Zusatzstoff E 330 für Getränke wie Limonade, Süßigkeiten, zum Ansäuern von Brot und in der Fleischverarbeitung sowie in der Pharmazie, der Kosmetik und in Reinigungsmitteln eingesetzt. Heute liegt das Weltmarktvolumen bei mehr als 2 Millionen Tonnen und der Umsatz beträgt 3 Mrd. US-Dollar. Weitere organische Säuren aus der Produktpalette des Pilzes sind Gluconsäure und Äpfelsäure. Darüber hinaus stellt Aspergillus fermentativ wichtige Enzyme her. Etwa Glucoamylasen, die in der Lebensmittelindustrie Verwendung finden, sowie Glucose-Oxidasen. Glycosid-Hydrolasen bauen Hemicellulose und Cellulose ab, weshalb sie bei der Herstellung von Biokraftstoffen aus Agrarreststoffen wie Stroh eingesetzt werden. Als dritte Produktkategorie stellt der Pilz Sekundärmetabolite her, die etwa als Antibiotika oder Fungizide eingesetzt werden können.
Produktive Verwandte: Aspergillus oryzae wird im asiatischen Raum genutzt, um in Nahrungsmitteln wie Sake, Miso oder Sojasoße Stärke und Proteine aufzuschließen. A. itaconicus produziert Itaconsäure mit einer Weltjahresproduktion von 41.000 Tonnen. A. fumigatus und A. flavus erzeugen die Antibiotika Fumigatin bzw. Aspergillsäure.
Steckbriefpatin: Prof. Dr. Vera Meyer (TU Berlin)
Mehr über Vera Meyer und ihre Forschung gibt es in der Portätreihe: Die Biopioniere
Seite 9 von 14
Clostridium acetobutylicum – Spritproduktion ohne Sauerstoff
Merkmale: Wenn es im Labor streng riecht, könnte das ein Hinweis auf den ansonsten ungefährlichen Bodenkeim Clostridium acetobutylicum sein – er verdankt seinen Namen dem Umstand, dass er unter anaeroben Bedingungen durch Gärung Buttersäure herstellt. Er ist ein grampositives, begeißeltes Bakterium, das bei Temperaturen zwischen 10 und 65 Grad Celsius wächst. Unter aeroben Bedingungen bildet es Endosporen, die viele Jahre überleben können. Das inzwischen sequenzierte Genom besteht aus einem ringförmigen Genom mit 3,94 Millionen Basenpaaren sowie einem Megaplasmid mit 192.000 Basenpaaren.
Einsatzfelder: Die Industriekarriere von C. acetobutylicum begann vor rund 100 Jahren. Der spätere Gründungsvater und erster Staatspräsident von Israel, Chaim Weizmann, hatte vor dem Ersten Weltkrieg beschrieben, wie das Bakterium Zucker zu Aceton, Butanol und Ethanol (ABE) vergären kann. Bis Mitte des 20. Jahrhunderts war dieser sogenannte ABE-Prozess von großer Bedeutung. Dann wurde er aus wirtschaftlichen Gründen durch petrochemische Synthesen abgelöst. Inzwischen gewinnt die biotechnische Herstellung von Alkoholen für Biokraftstoffe aus Gründen der Nachhaltigkeit wieder an Bedeutung. Nahverwandte Mikroben können zudem langkettige Cellulose aus Pflanzen mit eigenen Enzymen abbauen oder auch Synthesegas oder CO2 und Wasserstoff für die Fermentation als Rohstoffe verwenden. Die Möglichkeit der Verwendung von industriellen Abgasen (etwa aus Stahlwerken) oder von kohlenstoffhaltigen Gasen, die etwa bei der Vergasung von Hausmüll entstehen, macht den Einsatz dieser Mikroben für Bioraffinerien interessant.
Produkte: Neben Aceton, Butanol und Ethanol bildet C. acetobutylicum auch Essigsäure und Buttersäure. Die größte Bedeutung hat dabei heute Butanol mit einer Jahresproduktion von 590.000 Tonnen. Butanol besitzt einen höheren Energiegehalt als Ethanol und gilt als technisch und ökologisch bessere Alternative für den Einsatz in Biokraftstoffen. Zwar wurden 2019 sogar mehr als 71 Millionen Tonnen Ethanol mit einem Marktwert von rund 40 Mrd. Euro biotechnologisch erzeugt, jedoch sind daran eine Reihe weiterer Mikroorganismen wesentlich beteiligt.
Produktive Verwandte: Neben C. acetobutylicum, dem natürlichen Produzenten von ABE, spielt heute C. autoethanogenum für die Fermentation von Ethanol auf Basis von Stahlwerksabgasen eine industrielle Rolle. Zukünftig werden jedoch rekombinante Stämme besonders für die Fermentation auf Basis von Synthesegas oder CO2 und Wasserstoff an Bedeutung gewinnen.
Steckbriefpate: Dr. Stefan Jennewein (Fraunhofer IME, Aachen)
Seite 10 von 14
Lactobacillus – Milchsäure für Lebensmittel und Bio-Folien
Merkmale: Ein bulgarischer Joghurt, in dem es entdeckt wurde, gab Lactobacillus delbrueckii ssp. bulgaricus seinen Namen. Das grampositive, stäbchenförmige Bakterium mit zwei bis neun Mikrometern Länge verstoffwechselt Milchzucker zu Milchsäure. Am wohlsten fühlt sich das Milchsäurebakterium bei Temperaturen zwischen 30 und 45 Grad Celsius, einem pH-Wert von 4,6 bis 6,2 und anaeroben Bedingungen. Das Genom des Stammes ATCC 11842 wurde bereits im Jahr 2006 sequenziert. Die Mikrobe ist für den Menschen wahrscheinlich gesundheitsfördernd und wird als Probiotikum eingesetzt.
Einsatzfelder: Lactobacillus delbrueckii wird primär für die Milchsäuregärung in der Joghurtherstellung und bei weiteren Molkereierzeugnissen genutzt. Bei Joghurt dient das Bakterium – meist der Stamm 2038 in Symbiose mit Streptococcus salivarius ssp. thermophilus – als Starterkultur. Zudem wird L. delbrueckii auch für die industrielle Produktion von Milchsäure eingesetzt.
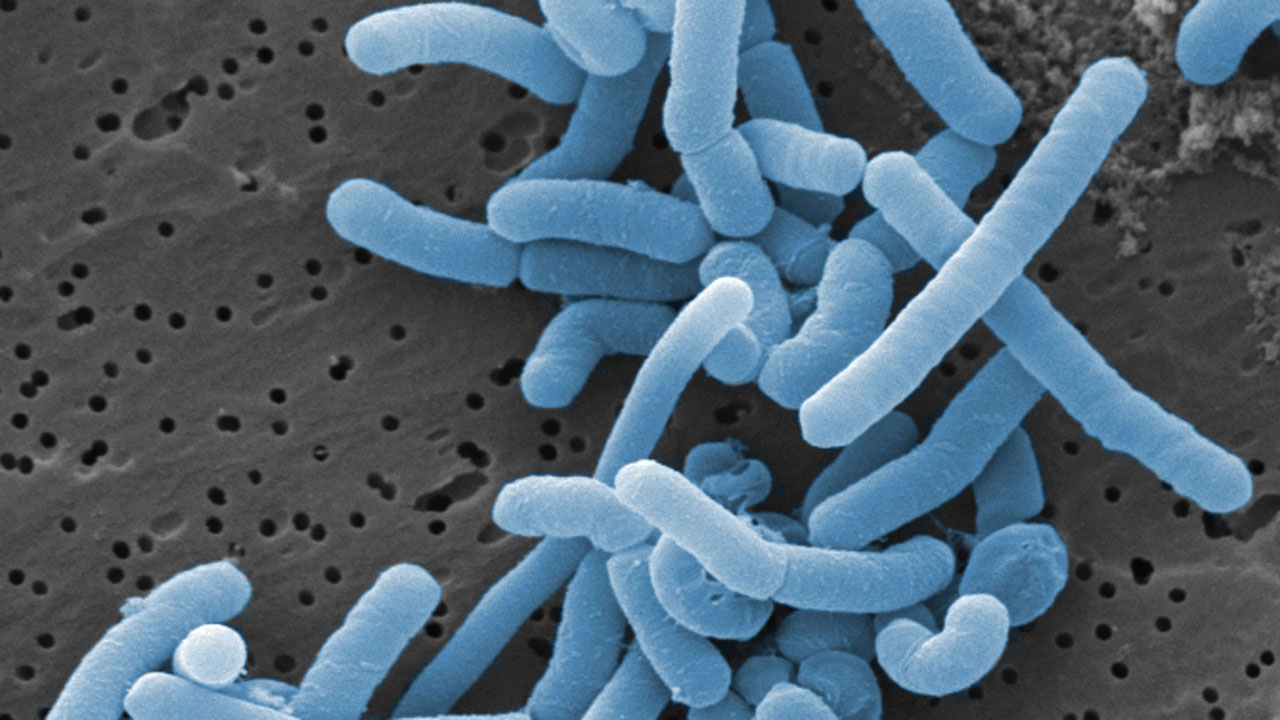
Produkte: Das wichtigste Produkt, für das L. delbrueckii genutzt wird, ist Joghurt mit einem weltweiten Marktvolumen von 85,5 Mrd. Euro im Jahr 2019. Hinzu kommen vor allem Quark und Sauermilchkäse. Milchsäurebakterien werden zudem als Zellfabriken eingesetzt, um im industriellen Maßstab Milchsäure herzustellen – derzeit sind es etwa 700.000 Tonnen pro Jahr weltweit. Als Lebensmittelzusatzstoff E 270 erhöht Milchsäure als Konservierungsmittel die Haltbarkeit von Back- und Süßwaren sowie Limonaden. Auch Seifen, Cremes und Spülmittel enthalten die desinfizierend wirkende Milchsäure. Durch Verknüpfung mehrerer Milchsäure-Moleküle entsteht das Biopolymer Poly-Lactid (PLA). Daraus gewonnene Materialien sind biologisch abbaubar, sodass sie zu Bio-Folien und -Verpackungen verarbeitet werden. Medizintechniker verwenden PLA für Nahtmaterialien und Implantate, die sich nach einiger Zeit im Körper zersetzen.
Produktive Verwandte: Neben dem sequenzierten Stamm ATCC 11842 und dem Stamm 2038 werden einige weitere nichtpathogene Lactobacillus-Stämme in der Molkereibranche verwendet. Gleiches gilt für eine Reihe von Arten aus der Gattung der Milchsäurebakterien, darunter L. casei und L. acidophilus. Letzterer erzeugt bei Joghurt einen milderen, weniger sauren Geschmack. Ein sehr ergiebiger Milchsäurebildner ist Bacillus coagulans.
Steckbriefpaten: Prof. Dr. Lars Blank (RWTH Aachen); Dr.-Ing. Joachim Venus (Leibniz-Institut für Agrartechnik und Bioökonomie ATB Potsdam)
Seite 11 von 14
Acetobacter aceti – der Essigsäure-Fabrikant
Merkmale: Alle Vertreter der Gattung Acetobacter können, was ihr Name verspricht: Essigsäure herstellen. Dabei kommt ihnen ihre außerordentliche Oxidationsfähigkeit zugute. Bereits seit über 200 Jahren wird auf diese Weise im sogenannten Schnellessigverfahren Essig aus alkoholhaltigen Gemischen gewonnen – meist aus Wein, Bier oder alkoholischem Apfelsaft. Der berühmte Mikrobiologe Louis Pasteur entdeckte die Essigsäurebakterien vor 150 Jahren. Vor allem Acetobacter aceti hat es zu industriellem Erfolg gebracht. Das gramnegative Bakterium ist strikt aerob und bewegt sich mit Flagellen. Am wohlsten fühlt es sich bei 25 bis 30 Grad Celsius und einem leicht sauren pH-Wert von 5,4 bis 6,3. Auch hohe Konzentrationen an Essigsäure machen der Mikrobe nichts aus: man kann sie praktisch in Essig baden. Mit ihrem membrangebundenen, oxidativen Stoffwechsel kann sie eine Reihe von Zuckern und Zuckeralkoholen oxidieren und daraus Energie gewinnen. Das Genom von A. aceti besteht aus 3,3 Millionen Basenpaaren, die 3.122 Gene umfassen. Von diesen Genen kodiert mit 97% ein hoher Anteil für Proteine. Für den Menschen ist A. aceti unschädlich.
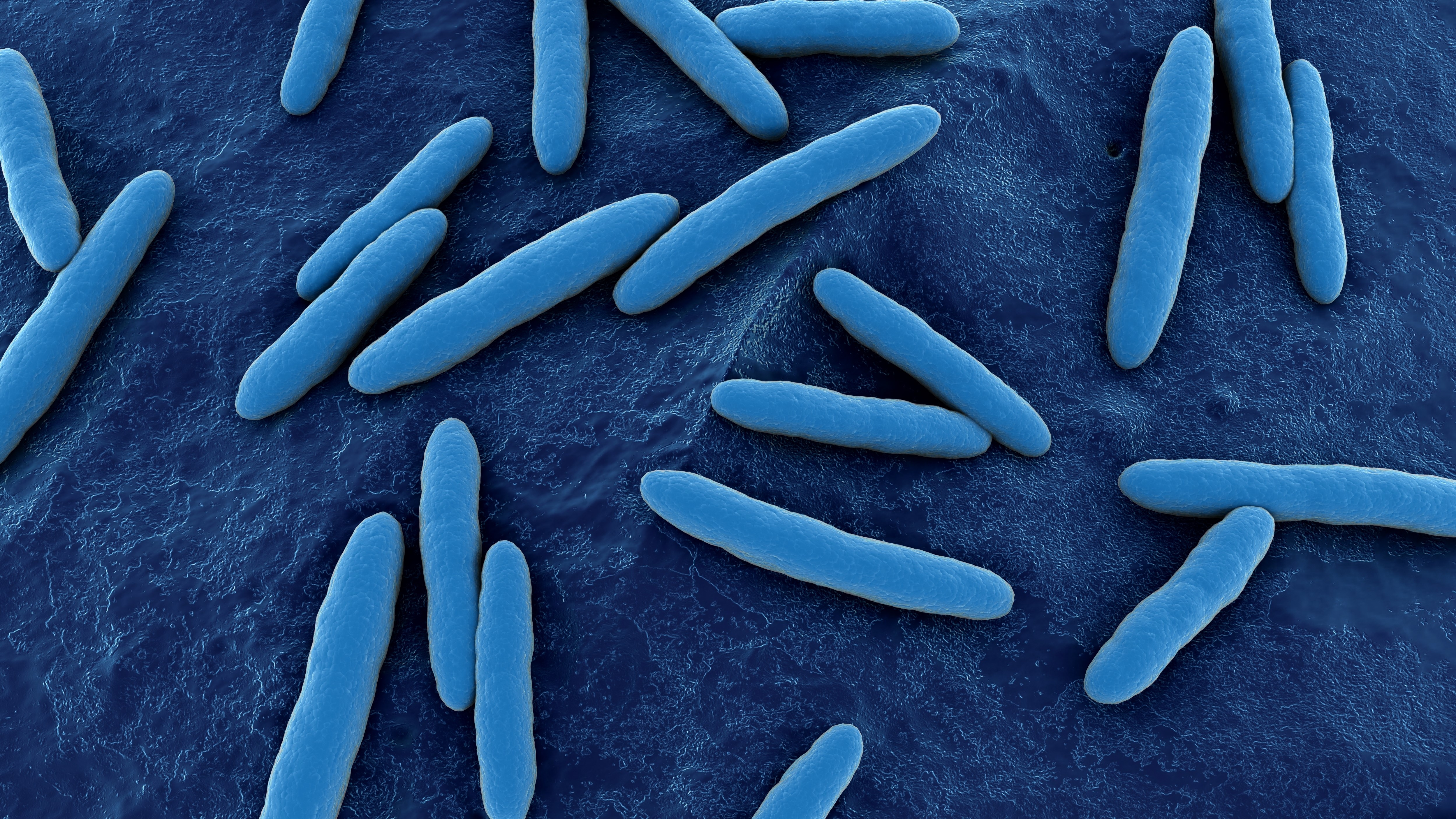
Einsatzfelder: Neben der Essigherstellung spielt A. aceti eine Rolle in der Kunststoff- und der Gummiproduktion. Das Bakterium kann nämlich eine Reihe interessanter Polymere synthetisieren, zum Beispiel bakterielle Cellulose oder Acetan. Eine Schlüsselrolle spielt A. aceti bei der Herstellung von Schokolade, wo es im Zusammenspiel mit Milchsäurebakterien und Hefen während der Fermentation von Kakaobohnen die Bildung der allseits beliebten Aromen ermöglicht. Die Forschung interessiert sich zudem für die Mikrobe, weil sie in sauren Milieus überleben kann und deshalb säurestabile Proteine besitzt.
Produkte: Das jährliche Produktionsvolumen der Essigsäure liegt bei 1,4 Millionen Tonnen und dient im Wesentlichen der Herstellung von Essig.
Produktive Verwandte: Neben A. aceti findet sich eine Reihe verwandter Spezies wie A. cerevisiae, A. malorum oder A. pasteurianus in industriellen Essigsäureprozessen. Weitere Arten der Gattung Acetobacter sind an der Fermentierung bestimmter Gärgetränke wie dem russischen Kefir oder dem japanischen Kombucha beteiligt. In der Kakofermentation wirken Arten wie A. ghanensis mit. Das verwandte Bakterium Gluconobacter oxydans spielt eine wichtige Rolle bei der Herstellung von Vitamin C.
Steckbriefpate: Prof. Dr. Christoph Wittmann (Universität des Saarlandes)
Seite 12 von 14
Pinselschimmel Penicillium – der Antibiotika-Lieferant
Merkmale: 1928 beobachtete der Brite Alexander Fleming zufällig die antibakterielle Wirkung einer Substanz, die Kolonien des Pinselschimmels Penicillium notatum absonderten. Diese Entdeckung ebnete den Weg für die Entwicklung der Antibiotika und bedeutete eine medizinische Revolution in der Behandlung von bakteriellen Infektionen. In den vergangenen Jahrzehnten hat der Schimmelpilz mehrfach einen neuen Namen bekommen. Lange hieß er P. chrysogenum und seit Kurzem P. rubens. Der berühmte Schimmelpilz wächst als Myzel und bildet samtige Kolonien, die zunächst gelb-grün, später dunkelgrün mit Rot- oder Blauanteilen gefärbt sind. Optimal wächst P. rubens bei 23 Grad Celsius, unterhalb von vier und oberhalb von 37 Grad Celsius ruht das Wachstum. Das Genom verteilt sich auf vier Chromosomen, umfasst 34,1 Millionen Basenpaare und wurde 2008 vollständig sequenziert. Davon kodieren 57% mit etwa 13.000 Genen für Proteine. Der Pilz kann Allergien auslösen und beim Befall von Lebensmitteln diese durch Mykotoxine verderben.
Einsatzfelder: Im Zweiten Weltkrieg wurde der Schimmelpilz im Rahmen einer Forschungsinitiative aus Briten und US-Amerikanern zur Zellfabrik für Penicillin weiterentwickelt und die industrielle Produktion immer weiter optimiert. Unterschiedliche Stämme von P. rubens werden industriell genutzt, um hocheffizient und kostengünstig Beta-Lactam-Antibiotika zu produzieren, vor allem Penicillin G und Cephalosporine. Die Produkte sondern die Pilz-Myzelien ins Nährmedium ab. Jenseits der Antibiotika-Herstellung wurde Produktionsstämme entwickelt, die keine Penicilline, dafür aber interessante Enzyme herstellen können.
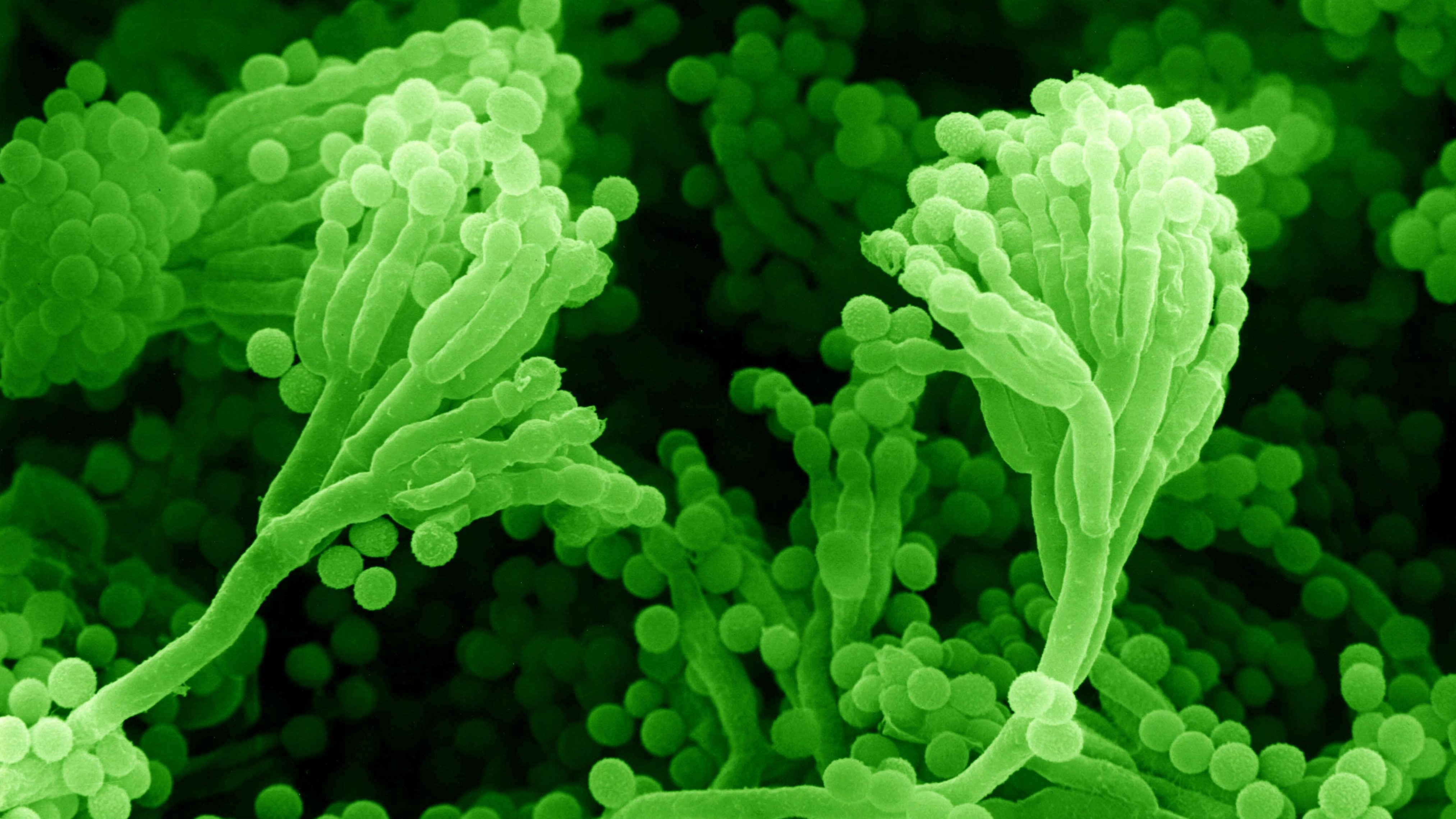
Produkte: Mittels P. rubes wurden mehr als 60.000 Tonnen Penicilline im Jahr hergestellt. Sie werden für die Human- und die Tiermedizin gegen bakterielle Infektionen eingesetzt.
Produktive Verwandte: Die Forschung untersucht weiterhin Stoffwechselprodukte mehrerer Penicillium-Arten auf weitere Substanzen, die als Antibiotika eingesetzt werden können, wenn Erreger gegen etablierte Penicilline resistent geworden sind – beispielsweise Yanuthone. Eine wichtige Zellfabrik für Antibiotika ist außerdem der Schimmelpilz Acremonium chrysogenum, der Cephalosporine erzeugt, deren Bezeichnung mit seinem ursprünglichen Namen Cephalosporium acremonium zusammenhängt. Penicillium camembertii spielt eine Rolle bei der Käsereifung.
Steckbriefpatin: Prof. Dr. Vera Meyer (TU Berlin)
Mehr über Vera Meyer und ihre Forschung gibt es in der Portätreihe: Die Biopioniere
Seite 13 von 14
Weitere Zellfabriken im Überblick
Neben den bereits vorgestellten Zellfabriken, die heute eine große Bedeutung in der Industrie haben, gibt es noch eine Reihe weiterer Mikroorganismen, deren Produkte bereits kommerziell biotechnologisch verwertet werden. Zu den mehr als hundert Arten zählen unter anderem:
| Gattung | Arten | Produkte/Einsatzbereiche |
| Arthrobacter | A. simplex, A. globiformis, A. nicotianae | Aminosäuren, Käseherstellung, Vitamin B12 |
| Brevibacterium | B. flavum, B. linens | Aminosäuren, Käseherstellung |
| Candida | C. kefyr, C. tropicalis | Käseherstellung, Kefirherstellung, Kakaoverarbeitung |
| Chlorella | C. vulgaris | Lebensmittelzusätze, Biokraftstoffe |
| Cupriavidus |
C. necator | Polyhydroxyalkanoate für bioabbaubare Kunststoffe |
| Methanobacterium | diverse | Biomethan |
| Mucor | M. racemosus | Kakaoverarbeitung, Käseherstellung |
| Pichia | P. fermentas | Kakaoverarbeitung |
Pseudomonas |
P. putida, P. syringae | Aminosäuren, Antibiotika, Bioremediation, Kunstschnee, Vitamine |
| Rhizopus | R. nigricans, R. oryzae, R. stolonifer | Zitronensäure, Ethanol, Fumarsäure, Glucoamylase, Milchsäure, Progesteron |
| Streptomyces | S. aureofaciens, S. griseus, S. lividans, S. noursei | Antibiotika, Vitamin B12 |
Seite 14 von 14
Neue Kandidaten mit Perspektive
Bakterien
Die Art Basfia succiniproducens wurde erst im Jahr 2008 im Pansen von Rindern entdeckt, hat aber schnell das Interesse der Biotech-Industrie geweckt, weil sie in vergleichsweise großer Menge Bernsteinsäure produziert und dazu eine große Palette an Substraten verstoffwechseln kann. Die Ordnung der Myxobakterien ist ebenfalls verstärkt als Zellfabriken in den Fokus gerückt, da deren Arten eine Vielzahl medizinisch und industriell nützlicher Stoffe bilden können. Darüber hinaus untersucht die Forschung kontinuierlich weitere Bakterien auf ihre Eignung als Zellfabriken.
Archaeen
Archaeen gehören zu den ältesten Lebewesen. Sie sind daher an urzeitliche Lebensbedingungen angepasst und betreiben in erster Linie anaerob Stoffwechsel. Das macht die Kultivierung im Labor kompliziert, weshalb diese eigentlich als Zellfabriken sehr interessanten Mikroorganismen bislang weniger erforscht sind und vor allem wenige Standardwerkzeuge und -protokolle existieren, um mit ihnen zu arbeiten. Dabei sind Archaeen ebenso vielseitig wie anspruchslos. Unter anderem die vom Bundesforschungsministerium geförderten Projekte MethanoPEP oder HotAcidFACTORY wollen diese Grundlagen nun schaffen und erste Prozesse für die Industrie entwickeln. Schon heute sind Archaeen wesentlich an der Erzeugung von Biomethan in Biogasanlagen beteiligt, bislang infolge natürlicher Prozesse.
Mikroalgen
Während heute der Großteil der mikrobiellen Zellfabriken aus Bodenorganismen besteht, hat die Forschung in den vergangenen zehn Jahren zunehmend das Potenzial wasserbewohnender Mikroorganismen wie der Mikroalgen entdeckt. Hierzu zählen Kieselalgen und Cyanobakterien, viele Grünalgen und einige Rotalgen. Da diese Zellen Photosynthese betreiben, eröffnen sie ganz neue Möglichkeiten der Prozess-Energieversorgung, aber auch der biotechnologischen Prozesse selbst, da sie aus Licht, Wasser und Kohlendioxid wertvolle Chemikalien herstellen können.
Tierische Zellen
Bakterien beherrschen nicht die Glykosylierung von Proteinen, also das Anfügen von Zuckermolekülen, wie es in den höheren eukaryotischen und damit auch menschlichen Zellen charakteristisch ist. Außerdem werden oftmals eukaryotische Proteine in Bakterien anders gefaltet, sodass sich deren räumliche Struktur und damit auch die Funktionsweise ändern. Tierische Zellen können daher besser für die Erzeugung pharmazeutischer Produkte wie Impfstoffe und anderer rekombinanter Proteine genutzt werden. Etabliert sind beispielsweise Hamsterzelllinien (CHO) und Insektenzelllinien.
Pflanzenzellen
Auch pflanzliche Zellen lassen sich kultivieren, um Produkte in großen Mengen herzustellen. Häufig stehen dabei Proteine als pharmazeutische Wirkstoffe im Vordergrund, aber auch Duft- und Aromastoffe. Pflanzliche Zellen haben gegenüber tierischen Zellen den Vorteil, dass sie in der Regel nicht von Humanpathogenen befallen werden können. Beispiele sind das Moos Physcomitrella patens als Produktionssystem für Biopharmazeutika oder Eibenzellkulturen, mit denen das Krebsmittel Paclitaxel hergestellt wird.