
Allein in einem Gramm Boden lassen sich mehr als 1.000 Arten von Mikroorganismen finden. In den Laboren der Erde untersuchen Wissenschaftler unzählige Mikrobenarten. Die Anzahl derjenigen Mikroorganismen, die für das Gros der industriellen Anwendungen der Biotechnologie relevant sind, lässt sich jedoch an zwei Händen abzählen. Vertreter der ältesten Domäne des Lebens, der Archaea, finden sich darunter nicht. Lediglich als Teil der Mikrobengemeinschaft, die in Böden und Sedimenten Biomasse abbaut – industriell genutzt für die Biogasherstellung –, sind methanogene Archaeen bislang großtechnisch in Erscheinung getreten.
Finanziert mit rund 2,2 Mio. Euro im Programm „Mikrobielle Biofabriken für die industrielle Bioökonomie - neuartige Plattformorganismen für innovative Produkte und nachhaltige Bioprozesse“ des Bundesministeriums für Bildung und Forschung ist nun ein Forschungskonsortium angetreten, um einen ganz neuen Bereich der Biotechnologie auf Grundlage methanogener Archaeen aufzubauen. Dabei ist der Name Programm: MethanoPEP – Methanogene als Plattformorganismen zur Energiespeicherung, Gen-Expression und Produktion von Chemikalien höherer Wertschöpfung.
Aufwendige Kultivierung
Projektkoordinator Michael Rother von der TU Dresden hat eine einfache Erklärung für die Vernachlässigung der Methanogenen in der Wirtschaft: „Diese Mikroorganismen sind schwierig zu bearbeiten, da sie strikt anaerob sind. Die Methodologie für ihre Kultivierung ist aufwendig – und die Industrie will einfache Prozesse.“ Zwar gebe es anaerobe industrielle Prozesse, doch die Produkte der methanogenen Archaeen seien dafür nicht werthaltig genug.
Was aber macht Methanogene dann interessant? „Viele Mikroorganismen sind metabolisch vielseitig“, erläutert Rother, – sie können also eine Vielzahl interessanter Verbindungen herstellen –, „aber sie benötigen komplexe Substrate.“ Methanogene hingegen können nicht viel. Dafür benötigen sie nur einfache Energiesubstrate, oftmals reine Abfallstoffe.
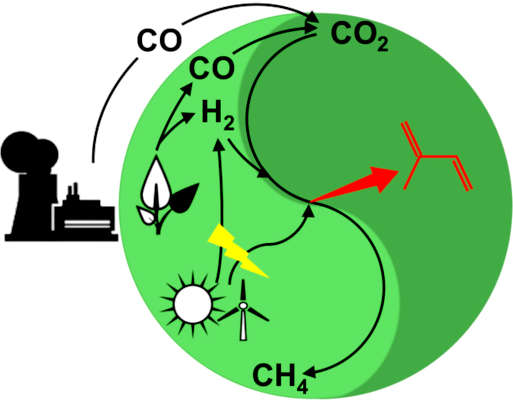
Vision des MethanoPEP-Projekts zur Entwicklung von Methanogenen zu Plattformorganismen: Neben Methan soll aus billigen, erneuerbaren Energiequellen (industrielle Abgase, Synthesegas aus Biomasse, Strom und Wasserstoff aus Wind- und Solarenergie) Mehrwert (roter Pfeil, Isopren/-oide als Beispiel) generiert werden.
Synthesegas als Substrat
Die Partner im Projekt MethanoPEP verfolgen deshalb eine Reihe von Zielen: Man möchte die genetischen Werkzeuge weiterentwickeln und vereinfachen, mittels derer der Stoffwechsel der Archaeen verändert werden kann. Viele genetische Werkzeuge setzen zudem bislang auf Antibiotikaresistenzen – etwas, das für industrielle Anwendungen nicht geeignet ist. Mit diesen neuen Werkzeugen sollen Modell-Methanogene so verändert werden, dass am Ende Stämme entstehen, die weitere Substrate wie Kohlenmonoxid nutzen können, das ein typischer Bestandteil des in der Industrie anfallenden Synthesegases ist. Als Alternative wird ein Verfahren entwickelt, um Methanogene über Elektroden direkt mit Strom zu „füttern“.
Ein weiteres Ziel ist es, mit solch angepassten Mikroben Isoprenoide, herzustellen. Dabei handelt es sich um Naturstoffe, die meist von Pflanzen hergestellt werden. Alle Archaeen beherrschen das gut, weil diese Stoffklasse den Hauptteil ihrer Membranen ausmacht. Vorstufen dieser Isoprenoide könnte man dann abgreifen und nutzen, um gezielt neue Stoffe daraus herzustellen. Bakterien produzieren von Natur aus keine relevanten Mengen an Isoprenoiden. „Diese Fähigkeit musste man in ihren Stoffwechsel erst genetisch einbringen, und dann waren sie immer noch auf teure Substrate wie Zucker angewiesen“, erläutert Rother den Vorteil der Archaeen. Zwar können auch Pflanzen Isoprenoide herstellen. „Aber Pflanzen wachsen langsam.“
Acetyl-CoA als Ausgangspunkt
Die Vision des Projekts ist ein Organismus, der sich von Kohlendioxid aus Abgas oder der Atmosphäre ernährt sowie von Wasserstoff, der aus erneuerbaren Energien oder mikrobiellen Prozessen stammt. Als Produkt wäre dann jede Plattformchemikalie denkbar, die sich aus Acetyl-CoA, einer zentralen Stoffwechselkomponente, ableiten lässt. Ob sich allerdings Intermediate aus dem Zentralstoffwechsel einfach folgenlos nutzen lassen, dürfte einer der Knackpunkte des Vorhabens werden. Der gesamte Prozess würde sich jedenfalls perfekt in eine biobasierte Kreislaufwirtschaft einfügen. Der Industriepartner Electrochaea GmbH aus München wird sich zudem der kommerziellen Realisierung von Projektzielen widmen.
Die elektronenmikroskopische Aufnahme zeigt ein methanogenes Archaeon.

Fünf erfahrene Verbundpartner
Für das Vorhaben, das von Februar 2020 bis Januar 2023 läuft, bringen die fünf Projektpartner entsprechende Expertisen mit. Die Arbeitsgruppen von Rother an der TU Dresden und das Team von Ruth Schmitz-Streit an der Christian-Albrechts-Universität zu Kiel forschen schon lange an Methanogenen, kennen deren Stoffwechsel und Genetik und verfügen über etablierte Stämme. Industriepartner Electrochaea betreibt bereits einen großtechnischen Prozess mit einem patentierten Stamm, der aus Überschussstrom Methan erzeugt: Der Strom dient der Herstellung von Wasserstoff, aus dem die Mikrobe dann gemeinsam mit Kohlendioxid Methan bildet. Schon heute erreicht das Unternehmen gute Ausbeuten und Wirkungsgrade. Einen weiteren sehr produktiven Stamm, der genetisch jedoch kaum erschlossen ist, wollen die Partner an der Eberhard-Karls-Universität Tübingen um Bastian Molitor genetisch zugänglich machen. An der Technischen Hochschule Mittelhessen hingegen schaut Dirk Holtmann auf die Elektroaktivität der Methanogenen: Anstelle von Wasserstoff, aus dem die Mikroben ihre Energie beziehen, wäre denkbar, sie so zu verändern, dass sie Elektronen direkt nutzen können.
Wirtschaftlichkeit in Sichtweite
Das alles in den drei Projektjahren umzusetzen und zusammenzufügen, ist sicherlich eine Herausforderung. „Es geht uns ja nicht nur um die Anwendung“, erläutert der Projektleiter. „Wir wollen auch Grundlagenwissen schaffen.“ Vor allem sei das Projekt ein Machbarkeitsbeweis – für die Co-Kultur von Stämmen, die Kohlendioxid und Kohlenmonoxid verwerten, für die Produktion von Monoterpenen durch Methanogene und für das mittelfristige Potenzial einer Biotechnologie mit diesen Organismen. „Der Marktwert der erstrebten Produkte ist nicht allzu hoch, aber durch kostengünstige Substrate wird die Wirtschaftlichkeit bald erreicht werden“, urteilt Rother optimistisch.
Autor: Björn Lohmann


