Unsere moderne Welt wäre ohne die chemische Industrie undenkbar. Doch die Branche stand in den vergangenen Jahrzehnten wie keine zweite für ökologische und gesundheitliche Probleme. Die oft erforderlichen hohen Temperaturen und Drücke führen zu einem enormen Energiebedarf. Nicht selten fallen während der Produktionsprozesse problematische Abfallstoffe wie Säuren oder Lösungsmittel an. Obendrein erfordert die Herstellung komplizierter Moleküle, wie sie beispielsweise in der Pharmazie benötigt werden, eine lange Abfolge technisch anspruchsvoller Reaktionsschritte. Dass es auch anders gehen kann, weiß die Wissenschaft seit den frühen 1980er Jahren. Damals wurde mit Insulin ein kompliziertes Biomolekül auf neue Weise produziert: in und von Mikroorganismen. Seitdem erlebt die Biotechnologie ein rasantes Wachstum.
Viele Vorteile gegenüber klassischer Chemie
„Biotechnologische Verfahren benötigen weniger Schritte, sind viel billiger und haben eine sehr hohe Spezifität“, erläutert Peter Schönheit, Mikrobiologe an der Universität Kiel, die weiteren Vorteile gegenüber der klassischen Chemie. Außerdem erzeugen die Mikroorganismen in ihrem Stoffwechsel stereospezifische Verbindungen. Chemische Verfahren hingegen produzieren oft eine Mischung von stofflich gleichen Molekülen, die aber in ihrer räumlichen Konstellation variieren – vergleichbar mit linker und rechter Hand, die spiegelbildlich, aber ansonsten identisch aufgebaut sind. Fast immer unterscheiden sich diese Varianten in ihrer biologischen Aktivität. Bekannt wurde das Problem seinerzeit durch Contergan, wo die eine Variante ein harmloses Schlafmittel war, die andere jedoch fruchtschädigend wirkte. Seitdem trennt die Industrie ihre Produkte in einem abschließenden Verfahrensschritt nach deren Stereospezifität, was weiteren Aufwand und weitere Abfallprodukte bedeutet.
Der Trick, durch den die Mikroorganismen die komplizierten chemischen Prozesse zustande bringen, heißt „Enzyme“, d.h. biologische Katalysatoren. Sie sind darauf spezialisiert, beispielsweise eine chemische Gruppe von einem Molekül auf ein anderes zu übertragen und so auch komplexe Verbindungen zusammenzusetzen. Die Baupläne für die Vielzahl unterschiedlicher Enzyme stecken im Erbgut aller Lebewesen, doch nicht alle Organismen produzieren die gleichen Enzyme. Das ist der Punkt, an dem das Forschungsprojekt „Thermogene“ ins Spiel kommt.
Andere Substrate ermöglichen andere Produkte
Gefördert mit rund 1,3 Mio. Euro aus dem Programm ERA-Net Industrial Biotechnology haben sich darin Forscher der Universität Exeter (Großbritannien), der Universität Kiel, der Universität Bergen (Norwegen), sowie der Firmen Molecular Technologies (Russland) und Sigma-Aldrich/Merck von März 2013 bis Juli 2016 auf die Suche nach besonders leistungsfähigen Enzymen gemacht. „Wir wissen, dass thermostabile Biokatalysatoren besonders robust sind“, erklärt Schönheit. Diese werden aus hyperthermophilen Mikroorganismen gewonnen, die bei Umgebungstemperaturen von 80 bis 110 °C optimal wachsen. „Diese Enzyme sind besser angepasst an harsche Bedingungen und resistenter gegen Lösungsmitteleinflüsse wie Ethanol oder Methanol, die in Industrieprozessen anfallen“, führt der Mikrobiologe weiter aus.
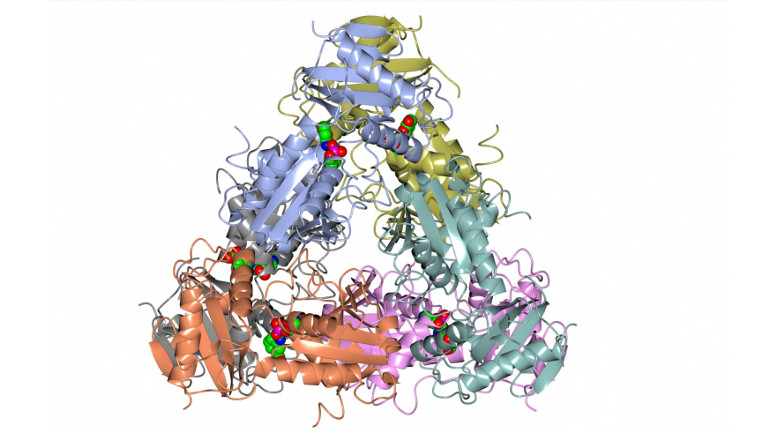
Eines der Projektresultate: So sieht die Kristallstruktur der Aminotransferase BCAT des hyperthermophilen Archaeons Archaeoglobus fulgidus aus.
Neben wenigen Bakterien sind es vor allem Mikroorganismen aus der Domäne der Archaeen, die heiße Lebensräume bevorzugen. In heißen Quellen, Geysiren und unterseeischen Vulkanschloten sind sie zu finden, dort, wo wahrscheinlich das Leben seinen Anfang genommen hat. Nach vier Gruppen von thermostabilen Enzymen wurde im Forschungsprojekt gesucht: Transaminasen, Transketolasen, Prenyltransferasen und Methyltransferasen. Diese Enzyme erzeugen neuartige Verbindungen von industriellem Interesse. Im Teilprojekt der Universität Kiel lag der Fokus besonders auf den Transaminasen. „70 Prozent alle pharmazeutischen Produkte enthalten chirale Amine“, beschreibt Schönheit die Bedeutung der Enzyme, die Aminogruppen von einem auf ein anderes Molekül übertragen. Aber auch Transketolasen spielen in der pharmazeutischen Industrie eine große Rolle, Prenyltransferasen werden bei der Herstellung von Geschmacks- und Aromastoffen benötigt, und Methyltransferasen sind nicht zuletzt ein wichtiges Werkzeug der Biotechnologie.
Gensequenzen in Datenbanken gesucht
Die Suche nach den Enzymen bestand zunächst darin, Datenbanken zu studieren. Aus der Sequenzierung des Erbguts genau untersuchter Bakterien wie Escherichia coli sind Gene bekannt, die in diesem Mikroorganismus für Transaminasen kodieren. Im Erbgut ebenfalls sequenzierter hyperthermophiler Organismen und in Metagenomen aus heißen Quellen ließen die Forscher die Computer nach homologen Sequenzen stöbern, immer in der Annahme, dass diese dann ebenfalls Transaminasen erzeugen würden, die thermostabil und damit geeignet sind für die biotechnologische Anwendung. Sie fanden etwa 15 vielversprechende Treffer.
Da hyperthermophile Organismen im Labor und insbesondere in industriellen Prozessen nur schwer kultivierbar sind, wurden für die Produktion größerer Mengen der gewünschten Enzyme gentechnischen Methoden verwendet. Dabei schleusten die Mikrobiologen zwei der gefundenen Gensequenzen mittels sogenannter Plasmide in E. coli-Bakterien ein, ein erprobtes Verfahren der Gentechnik. Die gut zu kultivierenden Bakterien produzierten das jeweilige fremde Enzym ohne Probleme. Auch die Reinigung des Enzyms stellte die Forscher vor keine Schwierigkeiten, da es – im Gegensatz zu seinem Wirt – hohe Temperaturen aushält und deshalb eine Hitzefällung möglich war: Während die thermolabilen Wirtsproteine ausfallen, bleiben die thermostabilen Enzyme in Lösung.
Alle Projektziele wurden erreicht
Anschließend testeten die Wissenschaftler die Enzyme auf deren kinetische und katalytische Eigenschaften, lösten deren Kristallstruktur und untersuchten, welche Substrate umgesetzt werden. „Wir haben eine erweiterte Substratspezifität gefunden“, schildert Schönheit einen Vorteil der neuen Enzyme, die noch bei 90 Grad stabil und katalytisch aktiv sind. Mit Hilfe der Strukturinformation lassen sich die Biokatalysatoren für den biotechnologischen Einsatz weiter optimieren.
Auch die anderen Kooperationspartner waren erfolgreich. „Für alle vier Enzymklassen hat das Projekt die Ziele erreicht“, freut sich Schönheit über die erfolgreiche Reinigung und Charakterisierung vieler Enzyme. Die Industriepartner nutzen jetzt die erzielten Ergebnisse des Projekts weiter für die Anwendung in biotechnologischen Prozessen. Und auch für Schönheit und seine Gruppe gibt es eine Art Fortsetzung: Mit einem neuen Konsortium suchen die Forscher weiter nach industriell nützlichen Enzymen – diesmal nach thermostabilen Isomerasen.
Autor: Björn Lohmann