Wertvolle Chemikalien aus Kohlendioxid und Ökostrom
Ein deutsches Forschungsteam hat ein bahnbrechendes Verfahren entwickelt. Jetzt steht es vor der Herausforderung, es hochzuskalieren.

Das Treibhausgas Kohlendioxid zu vermeiden, ist ein zentrales Anliegen der Bioökonomie. Andere Klimaschutzansätze sehen vor, entstandenes CO2 daran zu hindern, in die Atmosphäre zu gelangen – entweder in dem es an vermeintlich sicheren Orten deponiert wird, oder indem es chemisch zu Wertstoffen verarbeitet wird. Forschungsteams des Fraunhofer-Instituts für Grenzflächen- und Bioverfahrenstechnik (IGB), des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg und der TU München haben nun letzteres mit der Bioökonomie zusammengeführt. Dazu waren herausragende chemische Entwicklungen erforderlich.
Kohlendioxid vermeiden und zugleich aufwerten
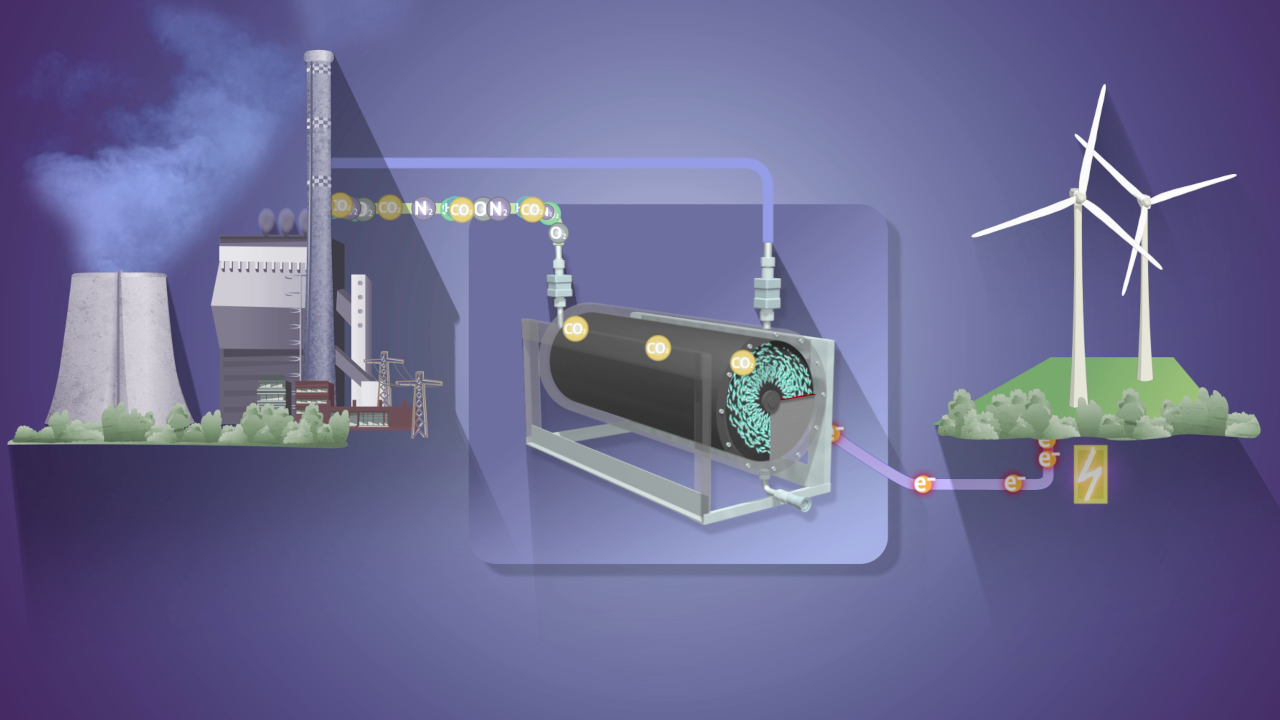
Im gemeinsamen Projekt „eBioCO2n“ ist es den Forschenden gelungen, aus Kohlendioxid und Ökostrom mithilfe von elektrobiochemischen und enzymbiologischen Verfahren sowie Methoden der Synthetischen Biologie Ausgangsmaterialien für Feinchemikalien zu erzeugen. Gelingt es in weiteren Schritten, das Verfahren großtechnisch weiterzuentwickeln, würde damit nicht nur das klimaschädliche Erdöl als bislang erforderlicher Rohstoff abgelöst, sondern obendrein CO2 der Atmosphäre entzogen – ein doppelter Gewinn für das Klima, solange der Prozess mit Ökostrom betrieben wird.
Spezielles Hydrogel ermöglicht hohe Effizienz
Der erste Meilenstein für das Verfahren bestand darin, ein besonderes Hydrogel zu entwickeln. Darin werden Enzyme eingebettet, die in der Lage sind, CO2 zu fixieren. Dafür benötigen diese jedoch Elektronen. Den Forschenden ist es gelungen, das Hydrogel so zu gestalten, dass es nicht nur in einer Ebene, sondern dreidimensional die Elektronen zu den Enzymen leiten kann. Die Enzyme werden aktiv und verwandeln in einer Reaktionskaskade CO2 in einen wertvollen chemischen Zwischenstoff. „Das Verfahren ist ein sehr effizienter Reaktionsweg, eine reduktive Carboxylierung, die sehr ökonomisch und sauber abläuft, weil man keine weiteren Substanzen im System braucht – lediglich Kohlenstoffdioxid, Substrat und Elektronen, bevorzugt aus erneuerbaren Quellen“, erläutert Leonardo Castañeda-Losada vom Fraunhofer IGB. Der dreidimensionale Aufbau des Hydrogels ist dabei eine vielversprechende Grundlage, um den Prozess später in den industriellen Maßstab überführen zu können.
Cofaktoren werden wiederverwendet
Bei dieser enzymatischen Reaktion sind normalerweise sogenannte Cofaktoren erforderlich, die im Prozess verbraucht werden und immer wieder neu – und kostspielig – zugeführt werden müssen. Dem Forschungsteam ist es jedoch gelungen, den Prozess so zu gestalten, dass die Cofaktoren durch Elektronen regeneriert werden und sich – theoretisch unendlich oft – erneut verwenden lassen. „Eigentlich müsste man nur ein einziges Mal Cofaktor ins System geben, und dieser würde dann immer wieder automatisch regeneriert“, erklärt Michael Richter vom Fraunhofer IGB. „Aber in der Praxis funktioniert das nur annähernd so gut, weil der Cofaktor nicht unendlich lange stabil bleibt –, aber durchaus schon sehr lange.“
Prozess für viele andere Chemikalien denkbar
Bei dem im Forschungsprojekt auf die neue Weise erzeugten Molekül handelt es sich um ein Coenzym-A-Derivat, ein für viele Stoffwechselvorgänge in Lebewesen wichtiges Biomolekül. „Hierbei handelt es sich um das bislang anspruchsvollste Molekül, an das auf biokatalytischem Weg CO2 fixiert werden konnte“, resümiert Richter. Und während es nun zunächst darum geht zu beweisen, dass all das nicht nur im Labormaßstab funktioniert, denken die Forschenden schon weiter: „Man kann aus bioinformatischen Datenbanken praktisch beliebig Enzyme auswählen, diese biotechnologisch herstellen und in die Hydrogele einbauen“, schildert Richter. „So wäre die Herstellung verschiedener biobasierter Feinchemikalien denkbar, die man bei entsprechendem Ausbau über weitere Enzymkaskaden praktisch nach Bedarf diversifizieren könnte.“
bl