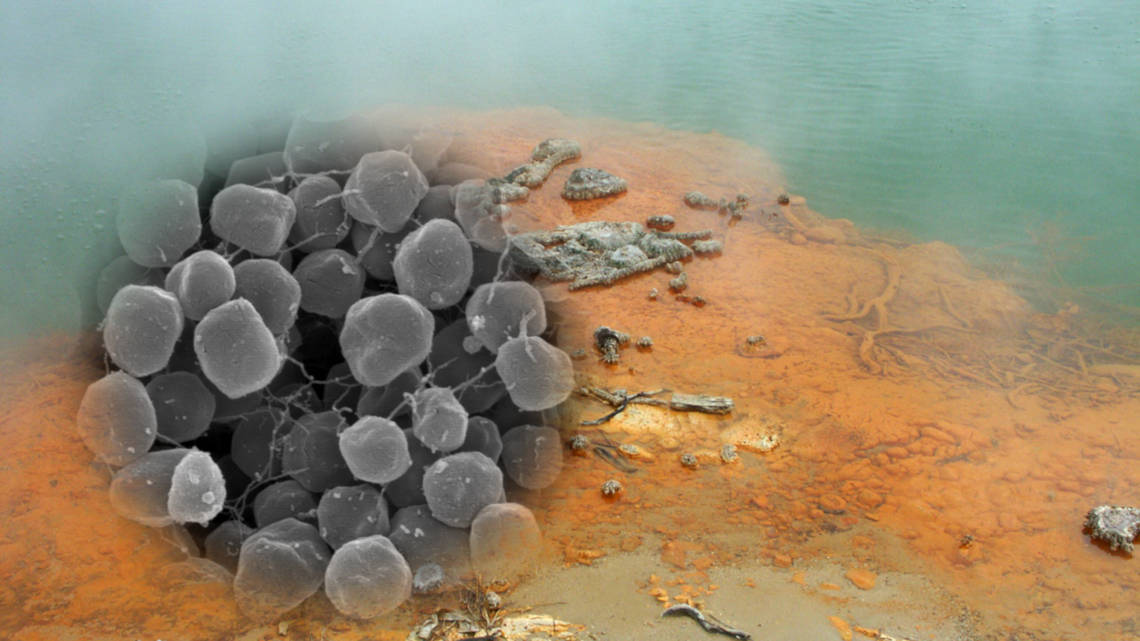
Escherichia coli, Bacillus subtilis oder Saccharomyces cerevisiae – die Namen mancher industriell genutzten Mikroorganismen sind selbst Laien schon einmal begegnet. Doch diese Arbeitspferde der industriellen Biotechnologie verbindet, dass sie eher milde Wachstums- beziehungsweise Reaktionsbedingungen bevorzugen. Für Prozesse oder Produkte, die erhöhte Temperaturen oder besondere pH-Werte erfordern, sind sie meist ungeeignet. Anders ist das bei sogenannten thermoacidophilen Archaeen, zu denen auch Sulfolobus acidocaldarius gehört. Bei 75 bis 80° C und in sauren Milieus fühlen sie sich erst richtig wohl.
Einfach zu kultivieren
Dass Archaeen bislang dennoch nur vereinzelt für Industrieprozesse genutzt werden, liegt unter anderem daran, dass grundlegende Kenntnisse des Stoffwechsels beziehungsweise der Physiologie sowie die genetischen Werkzeuge, um diese Mikroorganismen zu bearbeiten und zu optimieren, in der Regel fehlen. Das Projekt „HotAcidFACTORY“, das vom Bundesministerium für Bildung und Forschung im Programm „Mikrobielle Biofabriken für die industrielle Bioökonomie − Neuartige Plattformorganismen für innovative Produkte und nachhaltige Bioprozesse“ von 1.2.2020 bis 31.1.2023 mit 2,2 Mio. Euro gefördert wird, ist angetreten, das zu ändern. Beteiligt sind neben der federführenden Universität Duisburg-Essen die Universitäten Freiburg und Bielefeld sowie die TU Wien.
Bettina Siebers, Mikrobiologin der Universität Duisburg-Essen, arbeitet schon lange mit Archaeen und hat für das Projekt sofort an S. acidocaldarius gedacht. Der Mikroorganismus lässt sich recht einfach auf Komplex- oder Minimalmedien unter aeroben Bedingungen in einem Schüttler bei hoher Temperatur kultivieren. Siebers‘ Arbeitsgruppe hat in den vergangenen Jahren schon manches über den Stoffwechsel der Archaee herausgefunden. Das neue Projekt will dieses Wissen weiter vergrößern und vertiefen, um den komplexen Kohlenhydratstoffwechsel praktisch zu entschlüsseln.
Genetische Werkzeuge etablieren
Auch Methoden, um den Einzeller genetisch zu verändern, hat das Team schon vor Projektbeginn entwickelt. „Bislang haben wir dafür aber nur ein kleines Repertoire“, schildert die Projektkoordinatorin, „jetzt wollen wir das genetische System verbessern und auch CRISPR-Cas etablieren.“ Mit der als Genschere bezeichneten Methode der Genom-Editierung ließen sich Änderungen an einzelnen Genen schnell und verlässlich durchführen.
Die genetischen Methoden sind jedoch nur das eine. Vor allem wird die Frage spannend sein, ob S. acidocaldarius sowohl mit CO2 als auch mit Rohglycerin als Nährstoff wachsen kann. Letzteres fällt beispielsweise bei der Herstellung von Biodiesel an, enthält oft aber toxische Verunreinigungen, die das Wachstum von Mikroorganismen hemmen. Weil das Archaeon natürlicherweise mit recht widrigen Bedingungen zurechtkommt, hoffen die Forscher, dass das auch hier der Fall sein könnte.
Punktmutation reaktiviert Glycerinstoffwechsel
„Wir wussten, dass unser Mikroorganismus auf Fettsäuren und Lipiden wächst, und da beim Lipidabbau Glycerin als Kopfgruppe entsteht, lag die Frage nahe, ob er auch Glycerin nutzen kann.“ Einen Monat lang ließen die Forscher die Archaeen auf reinem Glycerin wachsen – und dann auf einmal geschah es: Die Einzeller ernährten sich von Glycerin. „Die Rückmutation einer Punktmutation in einem für den Abbau wichtigen Gen war entscheidend“, fasst Siebers das Ergebnis der genetischen Analysen zusammen. „Punktmutationen können sich bei Genen aus nicht benötigten Stoffwechselwegen anhäufen, da diese bei der Anzucht auf komplexen Medien nicht benötigt werden beziehungsweise nicht essenziell sind.“ Inzwischen sind sie und ihr Team recht weit dabei vorangekommen, auch die zugrundeliegenden Stoffwechselwege des Glycerinabbaus aufzuklären. „Dabei gehört für uns immer auch dazu, die beteiligten Enzyme zu charakterisieren“, betont die Mikrobiologin.
Schwieriger gestaltet sich die Situation beim Kohlendioxid. Der Literatur zufolge sollte S. acidocaldarius das Gas verstoffwechseln können. „In der Praxis hat das aber schon lange kein Labor mehr beobachtet“, berichtet Siebers. Allerdings gibt es einen nah verwandten Stamm, der die Fähigkeit nachweislich besitzt. „Es kursiert deshalb das Gerücht, dass irgendwann einmal die Stämme verwechselt worden sind oder keine Reinkultur verwendet wurde“, erzählt die Mikrobiologin. Deshalb wird im Projekt zunächst analysiert, welche Enzyme das Archaeon besitzt, die für die CO2-Fixierung notwendig sind, und „was noch fehlt, um mittels Metabolic Engineering die CO2-Fixierung zu etablieren“.
Viele Ideen für den industriellen Einsatz
Was genau S. acidocaldarius später einmal produzieren könnte, steht nicht im Fokus des Forschungsprojekts. Denkbar wären eine Reihe von Enzymen, denn so mancher Prozess erfordert heiße oder saure Prozessbedingungen – beispielsweise die Lignocellulose-Aufbereitung. Was heute einige physikochemische und enzymatische Vorbehandlung erfordert, bevor Mikroorganismen schließlich aktiv werden können, könnte mit dem thermoacidophilen Archaeon und extremophilen Enzymen als wirtschaftlich attraktive Ein-Topf-Reaktion funktionieren. Und auch in Prozessen, bei denen Bioalkohole oder flüchtige Verbindungen entstehen, könnte die Mikrobe attraktiv sein: Die für viele Organismen toxischen Chemikalien verdampfen in einem bei 80° C geführten Prozess und könnten so leicht entfernt werden. Zudem kann auf den Einsatz von Antibiotika bei der Kultivierung verzichtet werden, da verunreinigende Organismen unter diesen extremen Bedingungen nicht wachsen.
Ob alle Ziele des Projekts innerhalb der Laufzeit erreicht werden können, ist nicht zuletzt durch die Arbeitsbedingungen in der Pandemiesituation fraglich. Ideen für die Zukunft hat Siebers dennoch schon genug: „Man könnte zum Beispiel auch Bioalkohole oder Säuren mit unserem Mikroorganismus produzieren“, erwartet Siebers mit Blick auf die Eigenschaften des Archaeons. Und auch eine kontinuierliche Prozessführung mit S. acidocaldarius scheint in Sichtweite zu sein: Der österreichische Projektpartner an der TU Wien hat schon einige Erfolge darin erzielt, eine entsprechend hohe Zelldichte in industriell relevantem Maßstab zu entwickeln. Denn am Ende der vielen Forschungsarbeit soll schließlich eine neuartige mikrobielle Biofabrik stehen.
Autor: Björn Lohmann


