Die Weltbevölkerung wächst und damit auch die Nachfrage nach Fleischprodukten.
Zwar wird in Deutschland immer weniger Fleisch gegessen, aber in Entwicklungs- und Schwellenländern steigt der Bedarf. Doch die konventionelle Fleischproduktion – insbesondere die Tierhaltung – steht wegen ihrer negativen Folgen für Umwelt und Klima seit langem in der Kritik. Mit Hochdruck arbeiten Unternehmen und Forschungseinrichtung daher an sogenanntem Laborfleisch, das sowohl im Geschmack als auch in der Struktur mit dem tierischen Original mithalten kann. Vor allem Start-ups wie Innocent Meat aus Rostock gelten hier als Innovationstreiber.
Das Unternehmen um das Gründerduo Laura Gertenbach und Patrick Inomoto konzentriert sich auf die Entwicklung von innovativen Produktionssystemen für zellbasierte Lebensmittel. „Wir entwickeln automatisierte Prozesse und Anlagen für die Fleischindustrie und stellen zugleich die benötigten Verbrauchsmaterialien bereit – von Zellen über Zellkulturmedien bis hin zu Zellträgern, die für die Vermehrung kultivierter Zellen unerlässlich sind“, erklärt Inomoto, Technischer Direktor bei Innocent Meat und Leiter des Verbundprojektes ZUKUNFT.
Entwicklung essbarer, skalierbarer und kosteneffizienter Zellträger
Im Fokus des Vorhabens stand die Entwicklung von essbaren, skalierbaren und kosteneffizienten Zellträgern, die direkt in kultivierte Fleischprodukte integriert werden können. Das Verbundprojekt wurde von Oktober 2022 bis Dezember 2024 vom Bundesforschungsministerium mit knapp 271.000 Euro im Rahmen der Fördermaßnahme „KMU-innovativ: Bioökonomie“ gefördert.
Zur Herstellung von zellbasiertem Fleisch werden Stammzellen mithilfe biotechnologischer Verfahren aus den Muskelzellen von Tieren gewonnen und in einem Nährmedium kultiviert und das, ohne ein Tier zu töten. „Eine der größten Herausforderungen ist derzeit die Skalierbarkeit dieser Technologie. Die Produktion im industriellen Maßstab stößt bislang an technische Grenzen“, erklärt Inomoto.
Mit Scaffolds komplexe Gewebestrukturen bilden
Mit der Entwicklung von „Scaffolds“ verfolgte Innocent Meat mit Forschenden vom Lehrstuhl für Mikrofluidik der Universität Rostock im Projekt einen neuen Ansatz. Scaffolds sind dreidimensionale Strukturen oder Gerüste, die das Zellwachstum unterstützen und die Bildung komplexer Gewebestrukturen wie Muskelgewebe und Fett ermöglichen. „Diese Zellträger sind eine Voraussetzung, um primäre Stammzellen in großem Maßstab für die Herstellung von kultiviertem Fleisch zu vermehren“, erklärt Inomoto.
Zur Herstellung der Mikroträger nutzte das Team adhärente adulte Stammzellen, konkret Myosatelliten-Zellen. Diese Gewebestammzellen, die bei Menschen und Tiere gleichermaßen vorkommen, haben die Fähigkeit, sich zu vermehren und anschließend in Muskel- oder Fettgewebe zu differenzieren. „Man kann sich diese Zellen wie schlafende Reserven zwischen den Muskelfasern vorstellen. Durch biologische Signale – etwa eine Verletzung oder intensives Krafttraining – werden sie aktiviert und verwandeln sich in neues Muskelgewebe, während ein kleiner Teil wieder für die Auffüllung der Reserve genutzt wird“, so der Projektleiter. Diesen natürlichen Prozess hat das Team im Projekt nachgebildet.
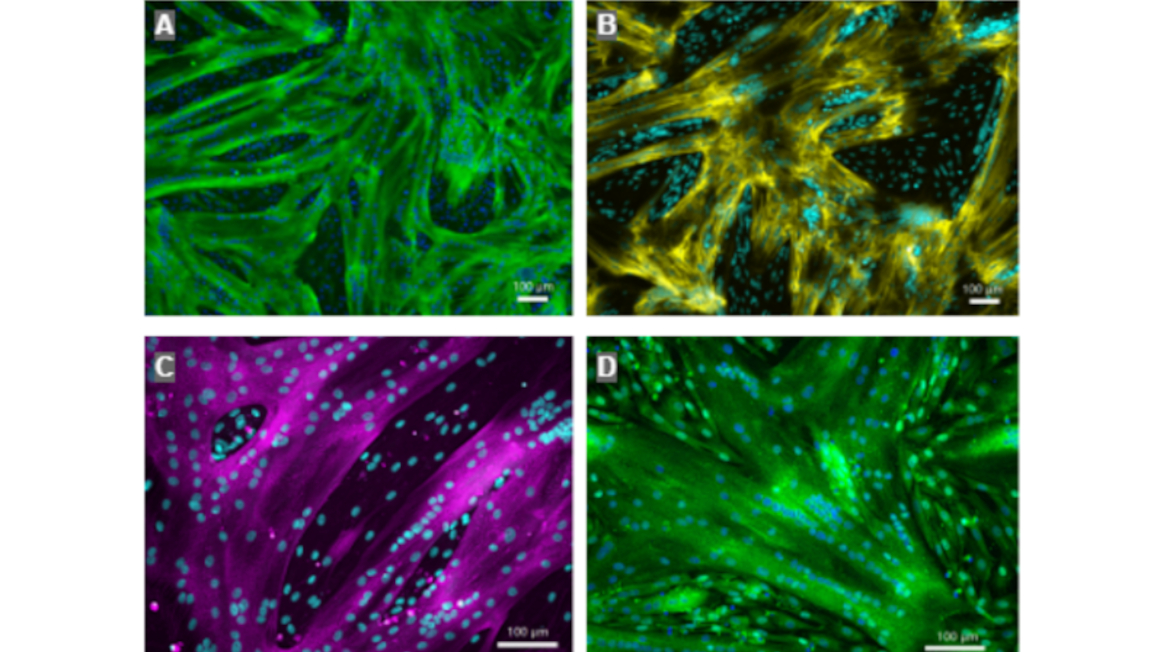
Am Anfang stand die Isolierung der Zellen aus dem Muskelgewebe von Schweinen, das ein Schlachtbetrieb in Form kleiner Fleischstücke bereitstellte. Die Kultivierung der Schweinezellen erfolgte dann in einem Bioreaktor. Damit sich die Zellen dort optimal vermehren, benötigten sie nicht nur Nährstoffe, sondern auch ausreichend Platz zum Anhaften und Wachsen. Hier sollten nun die im Projekt entwickelten Zellträger zum Einsatz kommen.
Makroporöse Mikroträger im Einsatz
Die Grundidee war, makroporöse Mikroträger zu entwickeln, also Strukturen mit porenartigen Hohlräumen, ähnlich der Löcher im Käse. Diese Poren sollten nicht nur groß genug sein, dass die Fleischvorläuferzellen eindringen und sich an den Oberflächen im Innenraum anlagern können. Sie sollten auch wie ein Tunnelsystem miteinander verbunden sein, um den Zellen ausreichend Raum für Wachstum und Vermehrung zu bieten und schließlich ein Maximum an Biomasse – also kultivierten Zellen – erzeugen.
Die entstehende Biomasse ohne großen Aufwand vom Gerüst zu trennen, wäre Inomoto zufolge mit hohem Kosten- und Prozessaufwand verbunden. „Deshalb haben wir uns entschieden, ein essbares Material als Zellträger zu nutzen, das im Endprodukt einfach verbleiben kann“. Zellträger, die porös und zugleich essbar sind, gibt es bisher nicht. Hier war das Forschungsteam gefragt.
Essbare Zellträger aus Alginat
An der Universität Rostock wurden verschiedene Materialien erprobt, um einen solchen Zellträger zu entwickeln. Schließlich fiel die Wahl auf Alginat, einen natürlichen Stoff aus Braunalgen, der bereits als Gelier- und Verdickungsmittel, aber auch zur Herstellung von Wursthüllen genutzt wird. „Alginat eignet sich hervorragend, weil es die Textur von Fleisch sehr gut nachahmt und zudem als Lebensmittel bereits zugelassen ist“, erläutert Inomoto.
Zur Herstellung der Zellträger aus Alginat wurden wiederum zwei verschiedene Technologien getestet. Während das sogenannte Elektrospinning am Lehrstuhl für Mikrofluidik zum Einsatz kam, widmete sich Innocent Meat der Kryogelierung. „Wir haben beide Verfahren angewandt, die Zellträger hergestellt und anschließend in der Zellkultur getestet und verglichen. Letztlich haben wir uns für die Kryogelierung entschieden, da sie eine höhere Skalierbarkeit und bessere Funktionalität bietet.“
Bei der Kryogelierung werden Tropfen einer Alginatlösung in ein unterkühltes Lösungsmittel gegeben, wo sie gefrieren und kleine kugelförmige Strukturen mit eingeschlossenen Eiskristallen bilden. „Diese Strukturen werden anschließend vernetzt und dadurch verfestigt – ähnlich wie man es von Gelatine im Haushalt kennt“, erläutert Inomoto. „Beim späteren Auftauen schmelzen die eingeschlossenen Eiskristalle und hinterlassen ein Netzwerk aus Poren.“
Gewebeanteil der Alginatkugel bei 90 %
Das so entstandene poröse Alginatgerüst bot den Fleischvorläuferzellen genügend Platz, um sich zu vermehren und ausreichend Biomasse zu bilden. Das Entscheidende: „Diese Zellträger lassen sich beliebig hinzufügen, wodurch wir die Produktion schrittweise hochskalieren können“, betont Inomoto. Nach der Differenzierung der so erzeugten Stammzellbiomasse in Muskel- und Fettgewebe entstanden laut Inomoto Alginatkugeln mit einem Gewebeanteil von 90 % und einem Alginatanteil von weniger als 5 %. „Das resultierende Gewebe ist voll funktionsfähiges Muskelgewebe, das sich biologisch nicht vom tierischen Original unterscheidet. Auch die Nährstoffzusammensetzung entspricht nahezu konventionellem Fleisch“, resümiert der Projektleiter.
Verbundprojekt ZUKUNFT - Aufgabenverteilung
Innocent Meat: Projektleitung, Optimierung der Oberflächen des Trägermaterials und Test der Zellkulturen, Weiterentwicklung der Kryogelierung
Universität Rostock, Institut für Mikrofluidik: Test der Materialien zur Herstellung der Zellträger
Im Labor konnten so 100 Gramm kultiviertes Schweinefleisch hergestellt werden. Inomoto zufolge handelt es sich dabei nicht um ein festes Stück Fleisch, sondern um eine „breiige Masse“, aus der beispielsweise Wurst oder Leberkäse erzeugt werden kann. „Die Textur dieses verarbeiteten Produkts ist mit dem des Originals vergleichbar.“
Als Nächstes plant das Forschungsteam, die im Projekt entwickelte Pilotanlage zur Herstellung der essbaren Zellträger weiter zu optimieren und die Technologie in Richtung industrieller Maßstäbe zu skalieren. Aktuell kann die Anlage etwa 10 Liter Zellträger produzieren. „Damit können wir bis zu 50 Liter Reaktorvolumen befüllen und mehrere Kilogramm Fleisch erzeugen“, sagt Inomoto.
Demonstrationsanlage in Mecklenburg-Vorpommern geplant
Gemeinsam mit dem Forschungsteam der Universität Rostock hat Innocent Meat damit die Grundlage hin zu einer zellulären Landwirtschaft geschaffen. „Im kommenden Jahr planen wir den Bau einer Demonstrationsanlage in Mecklenburg-Vorpommern, in der wir tonnenweise kultiviertes Fleisch produzieren können. Parallel dazu wollen wir einzelne Produkte für die Zellkultur – etwa die entwickelten Zellträger – direkt kommerzialisieren. Auf diese Weise kann unsere Technologie auch anderen Unternehmen aus der Food- und Pharmaindustrie helfen, skalierbare und kosteneffiziente Prozesse zu entwickeln und zu etablieren“, so Inomoto.
Autorin: Beatrix Boldt