Mit Stammzellen aus Nabelschnurblut Fleisch produzieren
Einem Forschungsverbund ist es gelungen, Laborfleisch aus Stammzellen herzustellen, die schmerzfrei aus dem Nabelschnurblut von Ferkeln gewonnen wurden.
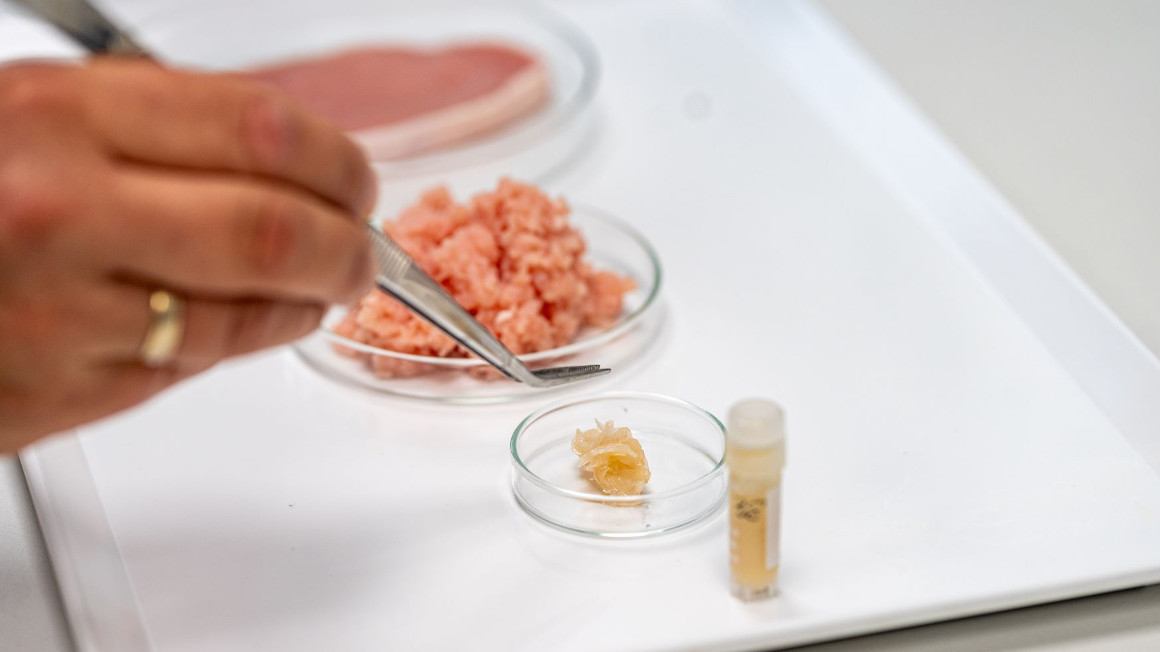
Um die wachsende Bevölkerung auch in 20 Jahren noch ernähren zu können, suchen Forschende seit langem nach Alternativen. Eine vielversprechende Option könnte Laborfleisch sein. Das Interesse an sogenanntem zellbasiertem Fleisch ist groß. Mittlerweile arbeiten zahlreiche Start-ups und Forschungseinrichtungen weltweit daran, Fleisch herzustellen, ohne dass ein Tier leiden oder getötet werden muss. Um zellbasiertes Fleisch herzustellen, werden meist Muskelstammzellen eines Tieres entnommen und in der Petrischale kultiviert. Im Projekt Cellzero Meat haben Forschende unter Leitung der Hochschule Anhalt nun erfolgreich einen völlig neuen Ansatz für die In-vitro-Produktion von Fleisch etabliert.
Stammzellen aus Nabelblut statt aus tierischen Muskeln
Statt Stammzellen aus den Muskeln von Tieren zu entnehmen, nutzte das Team Stammzellen aus dem Blut der Nabelschnur – konkret von Ferkeln. Diese innovative Entnahmemethode ist den Forschenden zufolge für das Tier völlig schmerzfrei und könnte daher eine Alternative zur bisherigen Stammzellentnahme sein.
Das Projekt Cellzero Meat wurde Juli 2022 bis Juni 2024 vom Bundesministerium für Bildung und Forschung (BMBF) im Rahmen des Ideenwettbewerbs „Neue Produkte für die Bioökonomie“ mit insgesamt 656.608 Euro gefördert. An dem Vorhaben beteiligt waren neben der Hochschule Anhalt, das Forschungsinstitut für Nutztierbiologie (FBN) in Dummerstorf bei Rostock, das Leibniz-Institut für Plasmaforschung und Technologie e. V. in Greifswald sowie die PAN-Biotech GmbH in Aidenbach.
Algen statt Tierserum als Nährmedium
Den Forschenden ging es im Projekt nicht nur darum, Tierleid zu meiden. „Wir wollten den Prozess insgesamt so nachhaltig wie möglich gestalten“, erklärt Wolfram Schnäckel von der Hochschule Anhalt. Um die Zellen im Bioreaktor wachsen zu lassen, wählte das Team daher ein Nährmedium aus Algen anstatt eines von geschlachteten Tieren. Auch wurde kaltes Plasma statt Antibiotika genutzt, um den Herstellungsprozess steril zu halten.
Fleischtypisches Gewebe und Geschmack
Nach zwei Jahren Forschung steht fest, dass der neue Ansatz funktioniert. Wie das Team berichtet, haben die Stammzellen aus dem Nabelschnurblut in dem Nährmedium aus Algen wie erhofft Muskel-, Fett- und Bindegewebszellen gebildet. „Aus ihnen lässt sich über ein 3D-Druck-Verfahren fleischtypisches Gewebe herstellen – für Produkte vom Burger-Patty bis zum Schnitzel“, schreiben die Forschenden. „Selbst der fleischtypische Geschmack, der erst während der Lagerung heranreift, wird von unserem Laborfleisch gebildet“, betont Schnäckel.
Noch sind es nur „wenige Gramm“ Laborfleisch, die im Bioreaktor auf diese Weise hergestellt wurden. Als Nächstes wollen die Forschenden die nachhaltige Methode weiterentwickeln, um das zellbasierte Fleisch auch im industriellen Maßstab herstellen zu können. Folgeprojekte für dieses Scale-up sind demnach bereits in Planung.
Neue Einnahmequelle für die Landwirtschaft
Die im Projekt Cellzero Meat entwickelte neuartige Methode zur Herstellung von In-vitro-Fleisch würde aber nicht nur Tierleid oder eine Schlachtung verhindern. Schnäckel sieht darin noch einen weiteren Vorteil: „Zudem wäre der Verkauf von Nabelschnurblut eine zusätzliche Einnahmequelle für die Landwirtschaft, wenn sich Laborfleisch auch auf europäischen Märkten durchgesetzt hat.“
Singapur und die USA sind weltweit die einzigen Länder, in denen Fleisch aus dem Labor bereits zugelassen ist. In der EU ist der Verkauf von zellbasiertem Fleisch noch nicht gestattet. Als weltweit erstes Unternehmen hat The Cultivated B aus Heidelberg bei der Europäischen Behörde für Lebensmittelsicherheit (EFSA) im September einen Antrag auf Zulassung eines zellbasierten Wurstproduktes gestellt.
bb


