
Carrageen – das klingt vielleicht exotisch, ist aber für viele Menschen längst Teil ihres Alltags: In Joghurt, Eis oder Zahnpasta sorgt es dafür, dass Konsistenz und Stabilität stimmen. Carrageen ist ein pflanzliches Gelier- und Verdickungsmittel. Es wird in vielen Lebensmitteln als Zusatzstoff E 407 verwendet und ist ohne Mengenbeschränkung zugelassen. Der Stoff stammt aus Rotalgen und besteht aus langen Zuckerketten mit vielen sogenannten Sulfatgruppen. Genau diese Sulfatierung macht Carrageen interessant – und gleichzeitig komplex. Denn je nachdem, wo und wie viele dieser Gruppen sitzen, ändern sich die Eigenschaften der Substanz drastisch. Das bietet enormes Potenzial, war bislang aber schwer gezielt steuerbar.
Neue Variationen eines etablierten Zusatzstoffes
„Ich habe lange in der Industrie mit Biopolymeren aus Rotalgen gearbeitet“, erzählt Volker Sieber, Biotechnologe an der TU München. „Daher fand ich die Idee spannend, Variationen dieser Polymere mit anderen Eigenschaften herzustellen.“ Entstanden ist daraus das Forschungsprojekt BioTrim.
Ziel der Forschenden im Projekt BioTrim war es, eine maßgeschneiderte Sulfatierung zu ermöglichen: Sie wollten gezielt die Struktur und Funktion von Carrageenen verändern und damit den Weg ebnen für neue Anwendungen in der Lebensmittel-, Kosmetik- oder Biotechnologie. Außerdem interessierten sie sich für einen ganz bestimmten Zuckerbaustein, der in Carrageen enthalten ist: 3,6-Anhydro-D-Galaktose, ein vielversprechender Kandidat für biobasierte Chemikalien.
Enzymsuche in Meeresbakterien und in Datenbanken
Das Team suchte gezielt in Proben mit marinen Bakterien nach Enzymen, die Carrageen abbauen können – sogenannte Sulfatasen. „Parallel haben wir in Datenbanken nach ähnlichen Enzymen gesucht, die vielleicht auch das machen, was wir wollen“, erläutert Sieber. Letztlich erwies sich dies als der schnellere Weg. Mithilfe bioinformatischer Methoden identifizierten die Forschenden in den Genomen der Bakterien bestimmte Gencluster, die auf solche Enzyme hinweisen. Die besten Kandidaten produzierten sie anschließend in E. coli, einem Modellbakterium der Biotechnologie, und testeten ihre Wirksamkeit mit einem selbst entwickelten Assay.
Mehrere interessante Enzyme identifiziert
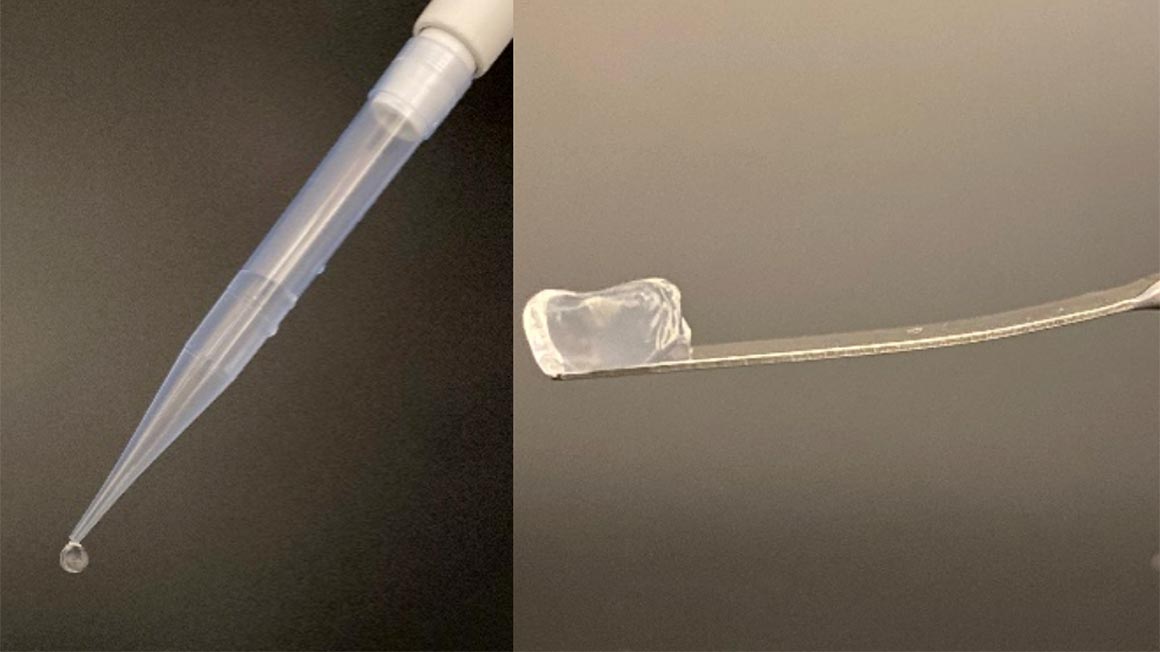
Die Forschenden identifizierten mehrere neuartige Sulfatasen, darunter auch solche mit bisher unbekannter Regiospezifität – also der Fähigkeit, Sulfatgruppen an ganz bestimmten Stellen zu entfernen. Besonders spannend war dabei, dass eines dieser Enzyme aus dem Gel-bildenden κ-Carrageen eine neue Form erzeugen konnte, die deutlich stärkere Gele bildet, ähnlich zu denen der deutlich teureren Agarose. Umgekehrt wurde aus ι-Carrageen eine Struktur mit nahezu völlig verlorener Gelierfähigkeit – obwohl sich die Moleküle nur durch eine einzige Sulfatgruppe pro Untereinheit unterschieden. „Es war schon toll zu sehen, wie wir zunächst die Polymere in eine Lösung gegeben haben, und mit den Enzymen bildete sich daraus dann ein Gel“, berichtet Sieber.
Außerdem gelang erstmals ein zellfreier biotechnologischer Prozess, um 3,6-Anhydro-D-Galaktose aus Carrageen zu gewinnen. Die Ausbeute liegt aktuell bei etwa 13 % für κ- und 7 % für ι-Carrageen – ein vielversprechender Anfang, der aber noch verbessert werden muss. Ein wichtiger Schritt für den gezielten Umbau des Carrageens war dabei die Kombination verschiedener Enzyme: Erst wurde das Carrageen mithilfe einer Hydrolase in kleinere Stücke gespalten. Dann kamen die Sulfatasen zum Einsatz, die gezielt Sulfatgruppen entfernten. Am Ende zerlegten weitere Enzyme die Zuckerkette in ihre Einzelteile – darunter auch der begehrte Zuckerbaustein 3,6-Anhydro-D-Galaktose.
Das Projekt BioTrim
Das Projekt BioTrim lief von Februar 2020 bis Januar 2024 und wurde vom Bundesministerium für Bildung und Forschung mit rund 340.000 Euro aus der Förderlinie „Bioökonomie International“ gefördert. Neben der TU München war auch die Universidade Estadual Paulista in Brasilien beteiligt.
Potenziale für Lebensmittel- und Kosmetikindustrie
Die Arbeit des Forschungsprojekts öffnet neue Türen: Mit maßgeschneiderten Enzymen lassen sich Carrageene künftig anwendungsgenau verändern – etwa für spezielle Texturen in Lebensmitteln oder bioaktive Inhaltsstoffe in Kosmetikprodukten. „Man könnte in der Lebensmitteltechnologie mit geringeren Mengen an Carrageen als Zusatzstoff ähnliche Eigenschaften erreichen“, gibt Sieber einen Ausblick. Gleichzeitig entsteht ein nachhaltiger Zugang zu wertvollen chemischen Plattformmolekülen aus marinen Ressourcen – ohne fossile Rohstoffe.
Der Projektleiter ist mit dem Erfolg sehr zufrieden: „Am Anfang war nicht klar, ob wir Enzyme finden, die an Polymeren aktiv sind“, erinnert er sich. Denn Polymere sind schwierige Substrate für Enzyme. „Als wir dann Stämme mit entsprechenden Aktivitäten gefunden haben, war das ein echtes Highlight.“ Letztlich konnten die Beteiligten die gesetzten Ziele erreichen.
Als Nächstes wollen die Forschenden die Enzyme weiter optimieren, deren Anwendungsmöglichkeiten erkunden und die Herstellung bioaktiver Oligosaccharide vorantreiben. Besonders im Fokus stehen neue Carrageenstrukturen mit speziellen Funktionen und eine bessere Effizienz im Herstellungsprozess.
Autor: Björn Lohmann


