Künstliche Photosynthese-Zellen gebaut
Paukenschlag in der Synthetischen Biologie: Marburger Bioingenieure haben künstliche Chloroplasten konstruiert. Sie betreiben effektiver Photosynthese als ihre natürlichen Vorbilder.
Einem Team um den Marburger Max-Planck-Forscher Tobias Erb ist ein spektakulärer Meilenstein auf dem Gebiet der Synthetischen Biologie gelungen: Zusammen mit französischen Kollegen haben die Bioingenieure künstliche Zellen konstruiert, die Photosynthese betreiben können - und das auch noch deutlich schneller als die natürlichen Pendants.
Die Photosynthese ist einer der ältesten Prozesse, um in Zellen Energie für den Stoffwechsel bereitzustellen. Mikroorganismen und Pflanzen erzeugen so aus Sonnenenergie, Kohlendioxid und Wasser Kohlenstoffverbindungen. Seit vielen Jahren träumen Chemiker davon, diesen Prozess nachzubilden und mittels Solarenergie und CO2 Zellen als winzige Bioreaktoren anzutreiben. Über ihre künstlichen Chloroplasten berichten die Forscher im Wissenschaftsjournal "Science" vor. Sie sind Ergebnis eines Projekts im Forschungsnetzwerk MaxSynBio, an dem neun Max-Planck-Institute beteiligt sind und das vom Bundesforschungsministerium seit 2014 gefördert wird.
Ein Stück Natur, ein Stück Synthetische Biologie
Die Fähigkeit zur Photosynthese hat sich das Team beim Spinat abgeschaut und dessen Enzymkomplex isoliert, der für die Photosynthese verantwortlich ist. Dieser Lichtreaktion genannte Schritt stellt Energie und Wasserstoff bereit. Hinzu kommt der Kohlenstoff aus der sogenannten Dunkelreaktion, für die die Forscher ein künstliches Stoffwechselmodul aus 18 Biokatalysatoren entwickelten. Die daraus resultierende Kohlenstoffumwandlung übertrifft die Leistungsfähigkeit des natürlichen Kohlenstoffmetabolismus der Pflanze. Bereits vor einigen Jahren hatte Erbs Team mit diesem künstlichen Stoffwechselweg zur CO2-Fixierung die Fachwelt begeistert.
Automatisierte Herstellung der Mikrotröpfchen
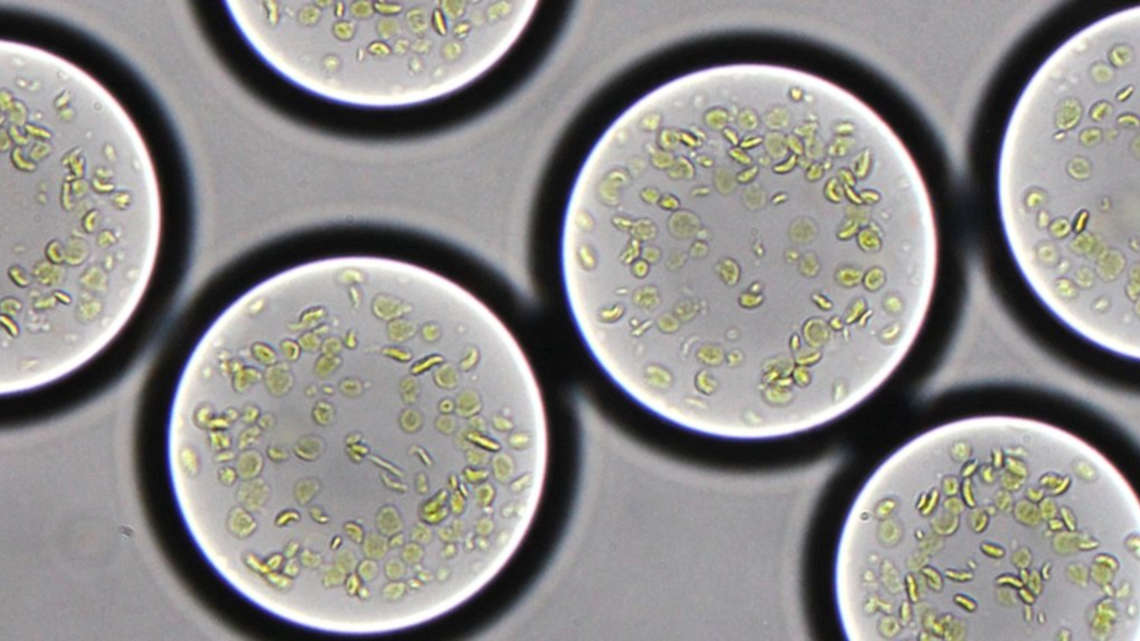
Um auf dieser Grundlage massenhaft und zugleich individualisiert herstellbare Mikrotröpfchen zu entwickeln – eine Art künstliche Chloroplasten, also jene Organellen der Pflanzenzelle, in denen die Photosynthese abläuft – griff das Max-Planck-Team zur Mikrofluidik. Gemeinsam mit dem französischen Centre de Recherché Paul Pascal entwickelten sie eine Plattform, welche die zuvor hergestellte halbsynthetische Photosynthesemembran in zellähnliche Tröpchen einschließt. „Wir können eine Vielzahl identisch ausgestatteter Tröpfchen herstellen oder einzelne mit spezifischen Eigenschaften versehen“, schildert Tarryn Miller, Erstautorin der Studie.
100-mal schneller als bisherige synthetische Systeme
Im Praxistest erwies sich, dass der künstliche Chloroplast Kohlendioxid 100-mal schneller bindet als die bisherigen Ansätze der Synthetischen Biologie. „Langfristig könnten lebensechte Systeme in praktisch allen technologischen Bereichen Anwendung finden, einschließlich Materialwissenschaften, Biotechnologie und Medizin“, so Tobias Erb, der in Marburg Direktor am Max-Planck-Institut für terrestrische Mikrobiologie ist. Da das synthetische System nicht innerhalb der Grenzen evolutionär entstandener biologischer Systeme agieren muss, sind neuartige und besonders schlanke Lösungen möglich. Und als charmanten Nebeneffekt beziehen die künstlichen Chloroplasten ihren Kohlenstoff aus der Atmosphäre und wirken so dem Klimawandel entgegen – ein Effekt, der natürlich erst im Großmaßstab relevant wird.
bl