„Die gezielte Umprogrammierung von Stoff-Flüssen im Stoffwechsel birgt ein beachtliches wirtschaftliches Potenzial“, so Bettenbrock. „Bisherige Prozesse sind mehr oder weniger statisch. Wir wollen die Zelle den Bedingungen möglichst gut anpassen“, erklärt die Mikrobiologin. „Dazu werden wir online, also während der Fermentation, gezielt in die Stoffwechselregulation der Produktionsorganismen eingreifen. Wir werden dazu bestimmte Zielgene unter die Kontrolle von künstlichen Promotoren stellen, die wir von außen – zum Beispiel durch Licht – während der Fermentation an- und ausschalten können. Zusätzlich wollen wir die zelluläre Regulation gezielt umbauen.“ Für den Erfolg des über fünf Jahre geförderten Projektes entscheidend ist es laut der Mikrobiologin, „herauszufinden, wie die Regulationsstrukturen aussehen müssen und wie ihre gezielte Ansteuerung erfolgen muss“. Bisher gibt es eine solche online-Steuerung eines oder mehrerer Gene nicht. In einem ersten Schritt werden die Forscher Produktionsstämme und -prozesse untersuchen und die wichtigsten Regulationsmechanismen in einem optimierten mathematischen Modell darstellen, das in München entsteht. Es soll helfen, Zielgene zu definieren, an denen die Regulation des Stoffwechsels angreift.
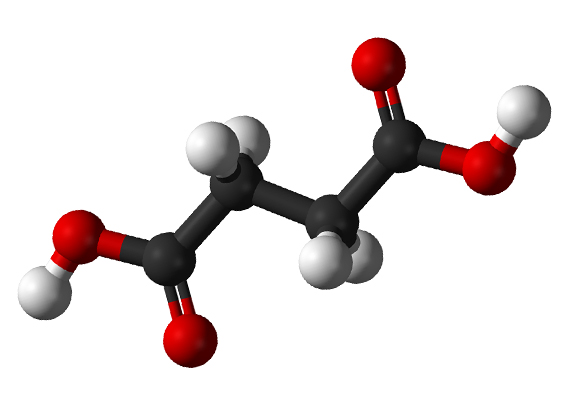
Als Modellprozess hat das Forschertandem die Herstellung der Basischemikalie Bernsteinsäure im Bakterium E. coli gewählt. Zwar wird Bernsteinsäure bereits industriell hergestellt, doch sehen Bettenbrock und Kremling noch „großen Optimierungsspielraum“. Bisher ist sind die Bedingungen, unter denen große Mengen an Succinat von E. coli produziert werden, nicht optimal für ein gutes Bakterienwachstum. „Wir wollen Zellen entwickeln, die unter guten Bedingungen rasch heranwachsen, die aber nachdem eine bestimmte Biomasse erreicht ist, auf Succinat-Produktion umgeschaltet werden können“, erklärt Bettenbrock. Später sollen die an dem Modellprozess gewonnenen Erkenntnisse auf andere biotechnologische Herstellungsverfahren übertragen werden. (tg)


