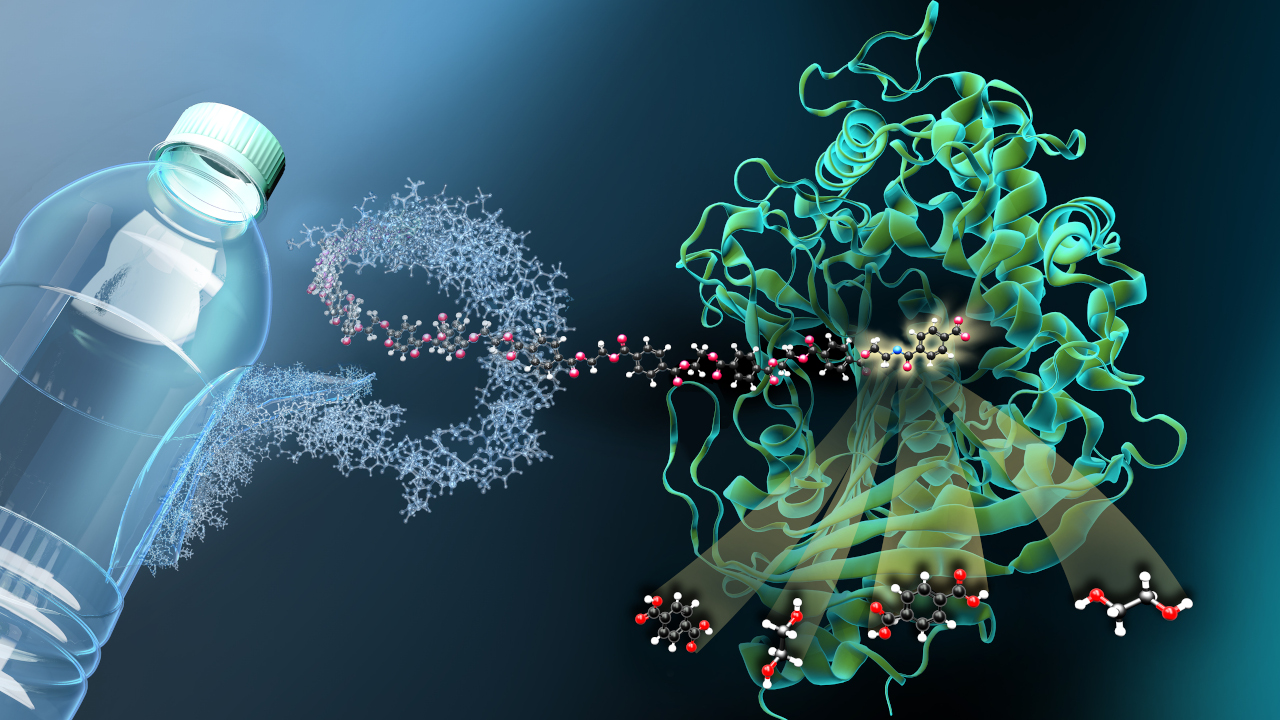
Corynebacterium glutamicum ist seit gut 50 Jahren ein echtes Arbeitstier der Biotechnologie – es produziert jedes Jahr 2,3 Millionen Tonnen des Geschmacksverstärkers Glutamat. Doch das Potenzial der vielseitigen Mikrobe ist noch lange nicht ausgeschöpft. Die Wissenschaftler des Projekts „FlexFit“ wollen die Fähigkeiten des Bakteriums weiter verbessern, um Produkte noch effizienter zu erzeugen. Hierfür haben sich Mikrobiologen, Biochemiker, Ingenieure und Systembiologen im Rahmen der Förderinitiative GenoMik-Transfer zusammengeschlossen. Bis August 2012 wird das Forscherkonsortium mit rund 3,3 Millionen Euro vom BMBF gefördert.
Neben dem Hauptprodukt Glutamat, das auch den Namen des Einzellers prägte, werden mit Hilfe des Bakteriums noch weitere Substanzen, insbesondere die Aminosäure Lysin mit 1,5 Millionen Tonnen pro Jahr industriell produziert. „Durch seine vorteilhaften Eigenschaften und die breite Produktpalette hat sich Corynebacterium glutamicum zu einem Plattform-Organismus der weißen Biotechnologie entwickelt,“ erklärt Michael Bott vom Forschungszentrum Jülich die Bedeutung des Bakteriums. Er koordiniert das Projekt, an dem Gruppen der Universitäten Ulm, Bielefeld, Köln, Bochum und Erlangen-Nürnberg sowie des Forschungszentrums Jülich beteiligt sind.
Rohstoffe flexibler nutzen
„Viele Produktionsabläufe sind schon optimiert, aber zum Beispiel bei der Nutzung von Rohstoffen gibt es Verbesserungsmöglichkeiten,“ beschreibt Bott einen Ansatzpunkt von FlexFit. Um die gewünschten Substanzen in großen Mengen zu produzieren, muss C. glutamicum „Nahrung“ zu sich nehmen. Das können entweder unterschiedliche Zucker, organische Säuren oder andere chemische Verbindungen sein, die man als Kohlenstoff-Quellen oder C-Quellen bezeichnet. Für die Industrie sollen diese C-Quellen vor allem billig sein und möglichst vollständig in das Produkt umgesetzt werden. Allerdings „isst“ C. glutamicum nicht alles – manche Stoffe können nicht aufgenommen und genutzt werden. Die Forscher des FlexFit-Projekts wollen nun die Vorlieben des Bakteriums erweitern, so dass mehr unterschiedliche Rohstoffe verwertet und etwa in die Aminosäure Lysin umgesetzt werden können. Hierfür bauen verschiedene Gruppen Gene von anderen Bakterien in C. glutamicum ein oder verstärken das Ablesen seiner eigenen Gene und verleihen ihm damit neue Fähigkeiten. Ein Beispiel für die erfolgreiche Arbeit von FlexFit ist die Aufnahme und Verwertung des Zuckers Trehalose. Er befindet sich zu einem gewissen Anteil in industriellen Rohstoffquellen, wird aber normalerweise von der Mikrobe verschmäht. Die Wissenschaftler des Projekts haben das geändert: „Wir haben herausgefunden, dass C. glutamicum nur Trehalose nutzen kann, wenn einige seiner Gene stärker als normal abgelesen werden“, so Bott. Auch Bestandteile von pflanzlichen Zellwänden und solche des natürlichen Baustoffs Chitin kann der Einzeller dank FlexFit nun verdauen.
Bioreaktoren zur Kultivierung von C. glutamicum unter definierten Bedingungen.

Fit auch ohne Sauerstoff
Neben der Nahrungsverwertung der Mikrobe steht auch seine Stressresistenz im Fokus der Wissenschaftler. C. glutamicum braucht Sauerstoff, um zu wachsen und das gewünschte Produkt bilden zu können. Doch in den riesigen Bioreaktoren, in denen sich die Bakterien vermehren, ist die Sauerstoffversorgung nicht immer überall optimal – die Folge: die Mikrobe ist gestresst und produziert unerwünschte Nebenprodukte. Für die FlexFit-Forscher gibt es mehrere Ansätze, um das Problem zu lösen: zum einen versuchen sie Enzyme anderer Bakterien in C. glutamicum einzuschleusen, die Sauerstoff besser binden können. Mit diesen effektiveren Enzymen könnte das Bakterium auch bei weniger Sauerstoff noch gut wachsen. „Leider ist uns das bisher noch nicht gelungen, weil die Enzyme sehr komplex aufgebaut sind“, beschreibt Bott den Stand der Forschung. Ein anderes Teilprojekt im Konsortium möchte herausfinden, ob das kleine, stäbchenförmige Bakterium nicht auch ganz ohne Sauerstoff interessante Produkte herstellen kann. Der Vorteil: „Dann muss man nicht ständig Sauerstoff in die Tanks hineinblasen – das verbraucht Energie und kostet Geld“, so Bott. Zudem stellen die Bakterien zwar das Produkt her, wachsen aber ohne Sauerstoff nicht weiter und verbrauchen somit auch keine Nährstoffe - ein finanzieller Vorteil für die Industrie.
GenoMik Transfer
Schnellere Suche nach produktiveren Stämmen
„Es ist ein langwieriger Prozess einen guten, nutzbaren Industriestamm zu erhalten und wir wollen dieses Verfahren beschleunigen“, formuliert Bott das dritte große Ziel des Projekts. Neue Stämme entstehen durch Veränderungen in Genen (Mutationen), die für die Produktion der Aminosäure wichtig sind. Die Forscher von FlexFit suchen nach bestimmten C. glutamicum Zellen, die aufgrund solcher Mutationen besonders viel Lysin produzieren und in die Umgebung abgeben. Hierfür haben sie einen molekularen Leuchtmarker entwickelt, der die Aminosäure-Konzentration in der Zelle anzeigen kann. Produziert die Zelle durch eine Mutation große Mengen an Lysin und gibt es in das Medium ab, dann leuchtet sie. Das ermöglicht eine extrem schnelle Selektion der interessanten Bakterien:
„Wir haben mit Hilfe eines Zellsortierers innerhalb von 30 Minuten aus sieben Millionen Zellen dreihundert isoliert, die stark geleuchtet haben“, so Bott. Die DNA dieser Bakterien kann dann isoliert und sequenziert werden, um zu sehen, wo eine Mutationliegt. Eine neue, noch unbekannte Veränderung haben die Wissenschaftler bereits mit ihrem System identifiziert. „Diese Mutation kann jetzt mit anderen, bekannten Mutationen kombiniert werden, um einen noch effizienteren Stamm herzustellen.“ Mit diesem neuen Nanosensor-System kann die Entwicklung und Charakterisierung von industriellen Produktionsstämmen nun wesentlich beschleunigt werden.
Die in dem Projekt gewonnenen Erkenntnisse teilen die Forscher mit ihrem Industriepartner Evonik Industries, der selbst Lysin und andere Produkte mit C. glutamicum produziert. „Unsere Zusammenarbeit mit Evonik Industries bringt für beide Seiten Vorteile: die Forscher erhalten Informationen über die industriell relevanten Probleme, der Industriepartner exklusiv neueste Forschungsergebnisse“, meint Bott.
In der altgedienten Mikrobe C. glutamicum, so hat sich jedenfalls jetzt schon gezeigt, steckt noch jede Menge Potenzial, um die Produktion industriell wichtiger Substanzen anzukurbeln.
Autorin: Vera Siegler