Enzymaktivität von Wassermolekül beeinflusst
Ein Forschungsteam der Universität Greifswald hat die detaillierte Struktur bestimmter Esterasen aufgeklärt sowie die besondere Rolle von Wassermolekülen im aktiven Zentrum der Enzyme.
Enzyme können einige Überraschungen bereithalten, wie die Kohlenhydrat-Esterasen zeigen. Diese Biokatalysatoren entfernen chemische Gruppen von komplexen Zuckerstrukturen und bereiten sie so für den Abbau durch andere Enzyme vor. Nun ist es dem Team um Uwe Bornscheuer vom Institut für Biochemie der Universität Greifswald gelungen, mithilfe von Röntgenkristallographie die vollständige Struktur zweier Vertreter der Enzymfamilie CE20 und deren Funktion zu entschlüsseln.
Wassermolekül übernimmt Schlüsselfunktion im Enzym
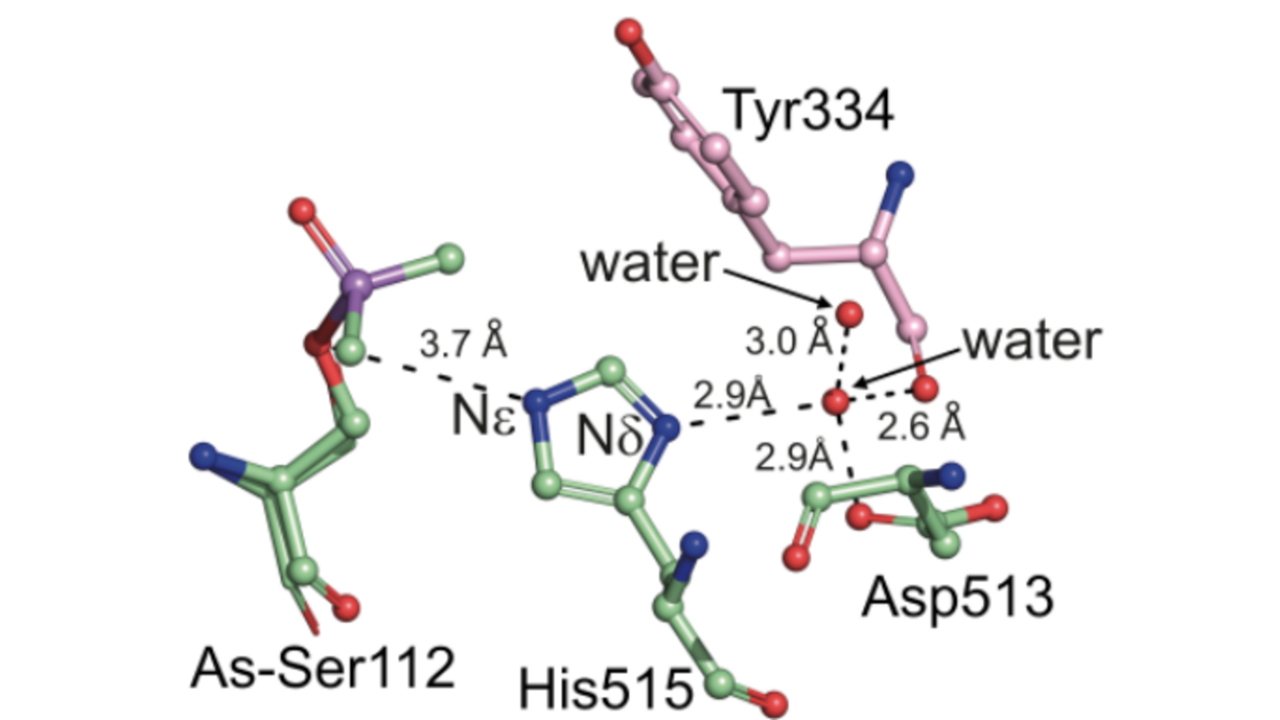
Bei den beiden Enzymen Fl8CE20_II und PpCE20_II ist das aktive Zentrum, das die chemischen Reaktionen ausführt, ungewöhnlich aufgebaut. „Normalerweise besteht dieses Zentrum aus drei genau platzierten Aminosäuren, die zusammenarbeiten“, erklärt Michelle Teune, Erstautorin der Studie. In den untersuchten Enzymen fehlte jedoch ein entscheidender Bestandteil dieser sogenannten katalytischen Triade. „Statt einer direkt beteiligten Aminosäure haben wir ein präzise eingebundenes Wassermolekül identifiziert, das die Funktion übernehmen kann.“
Die Aminosäuren Serin und Histidin sind in der Triade zwar vorhanden, die sonst typische Aspartat-Seitenkette jedoch wird durch ein koordiniertes Wassermolekül ersetzt. Dieses übernimmt die elektronische Polarisierung des Histidins während der Katalyse und wird durch ein benachbartes Aspartat stabilisiert. Die Forschenden bezeichnen diese neuartige Anordnung als wasservermittelte katalytische Triade – ein bisher nicht beschriebener Mechanismus, der das Verständnis enzymatischer Reaktionen grundlegend erweitert. Untersuchungen an verschiedenen Enzym-Mutanten zeigten, dass dieses Wassermolekül eine zentrale Rolle für die Aktivität spielt.
Neuer Mechanismus mit praktischer Relevanz
„Diese Studie zeigt, wie vorteilhaft wissenschaftliche Kooperationen sind“, so Bornscheuer. Die im Rahmen der DFG-geförderten Forschungsgruppe POMPU durchgeführte Arbeit wurde in Zusammenarbeit mit Forschenden aus Brasilien realisiert.
Die neuen Erkenntnisse sind nicht nur für die Grundlagenforschung von Bedeutung, sondern eröffnen auch praktische Anwendungsmöglichkeiten: Mithilfe dieser Biokatalysatoren könnten sich aus pflanzlichen und marinen Kohlenhydraten auf nachhaltige Weise wertvolle Produkte gewinnen lassen, etwa für den Einsatz in der Lebensmittelindustrie oder in biotechnologischen Verfahren wie der Herstellung von Biokraftstoffen.
chk