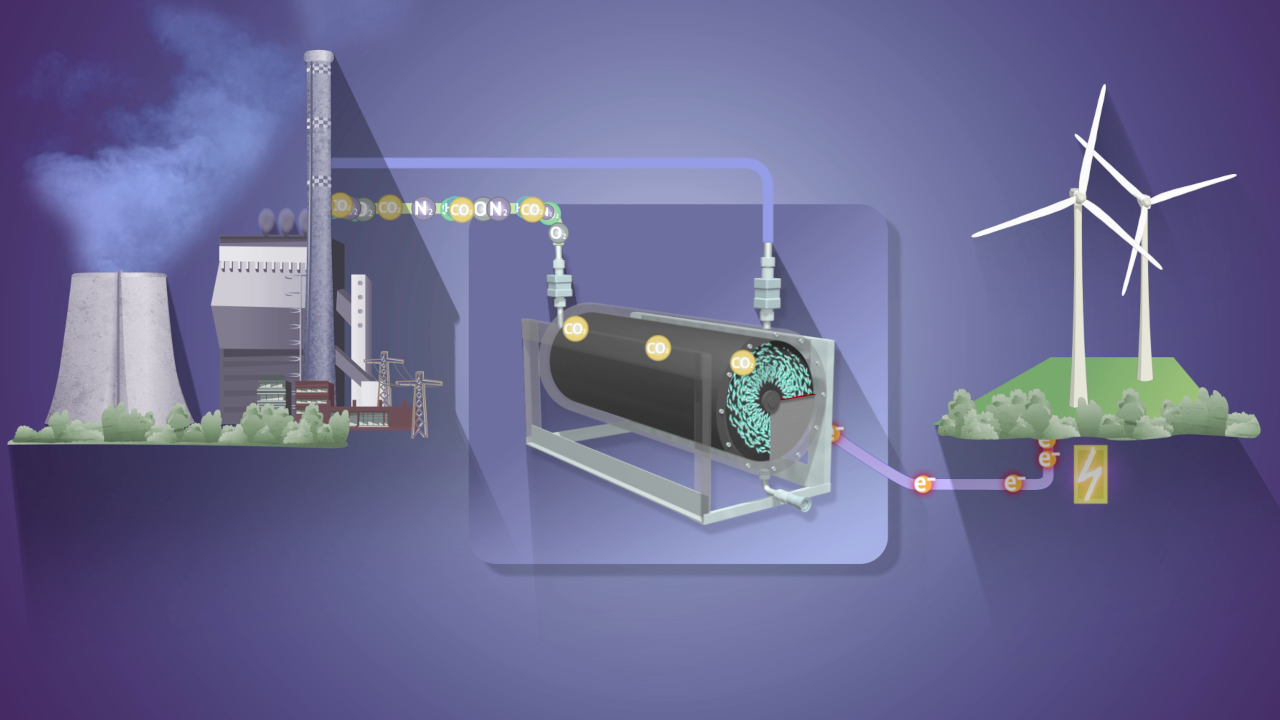
Es sind zwei Disziplinen mit großen Stärken: Die Biotechnologie auf der einen Seite ermöglicht sehr spezifische Reaktionen mit stabilen Katalysatoren. Die Elektrochemie auf der anderen Seite schleust besonders effizient Energie in chemische und biotechnologische Prozesse ein. Vor fast zehn Jahren stellte sich der Biotechnologe Dirk Holtmann gemeinsam mit seinem Kollegen Klaus-Michael Mangold aus der Elektrochemie die Frage, ob sich nicht beide Disziplinen gewinnbringend kombinieren lassen. Heraus kam das fünfjährige Forschungsprojekt „Mikrobielle Elektrosynthesen“ (MES), das als Projekt MES 2.0 von März 2018 bis Februar 2022 am DECHEMA Forschungsinstitut seine Fortsetzung fand.
Mehr Ressourcen- und Energieeffizienz
„Unsere Idee war es, beide Ansätze in einem einzigen Reaktor zu kombinieren und Reaktionen dadurch ressourcen- und energieeffizienter zu gestalten“, erinnert sich Holtmann, der heute am Karlsruher Institut für Technologie die Gruppe Elektrobiotechnologie leitet. Dabei stellten sich mehrere Fragen. Zum einen ist kein Organismus in der Natur dafür gemacht, mit Elektroden Energie auszutauschen. Dennoch gibt es Mikroorganismen, die genau das können. „Aber nur weil bekannt ist, dass sie das können, wissen wir noch nicht, wie. Und wie können wir das dann nutzen? Wie machen wir daraus einen Prozess? Und wie gut ist der Prozess am Ende?“, erläutert Holtmann, womit sich das Team zunächst auseinandersetzen musste.
Nachdem die Beteiligten in der ersten Förderperiode wichtige Grundlagen legen konnten, haben sie in MES 2.0 vor allem in vier Bereichen das Wissen über die Elektrobiotechnologie näher an die Anwendung herangeführt:
Wie entstehen Biofilme an einer Elektrode?
Die meisten Mikroorganismen benötigen direkten Kontakt mit der Elektrode, um Elektronen austauschen zu können. Sie wachsen dort als Biofilme. „Wir wollten daher verstehen, wie sich diese Biofilme bilden, welche Oberflächeneigenschaften der Elektrode dazu nötig sind und wie wir das Ganze dann optimieren können“, erklärt Holtmann das erste Ziel.
Klar zeigen konnte das Team, dass die Oberflächenparameter wesentlich sind, damit ein Biofilm sich ansiedelt – und vor allem wie schnell und wie stabil. „Aber es gibt weitere Parameter, die Effekte haben“, betont der Biotechnologe. Allerdings führten die gleichen Bedingungen bei unterschiedlichen Mikroorganismen zu unterschiedlichen Reaktionen. „Mit einem Parameter lässt sich die Biofilmbildung nicht erklären“, resümiert Holtmann. „Wir haben den Prozess jetzt deutlich besser verstanden, auch wenn es kein allgemeines Rezept gibt und man den Einzelfall genau betrachten muss.“ Dennoch geht der Biotechnologe davon aus, dass eine anwendungsreife Technologie daraus wohl noch 10 bis 15 Jahre Forschung erfordern wird.
Elektroaktives Bakterium molekularbiologisch verbessert
Ein weiterer Schwerpunkt der Forschung war das Bakterium Shewanella oneidensis. Es ist bekannt dafür, elektroaktiv zu sein. Das Team hat diese Eigenschaften ausgebaut. „Wir haben den Organismus molekularbiologisch verbessert und so verändert, dass er neue Produkte – Glutamat und Itaconsäure – herstellen kann“, erläutert Holtmann. Glutamat erzeugt das Bakterium in solchen Mengen, dass es als neues biotechnologisches Produktionssystem nutzbar ist. Seinen Energiestoffwechsel wickelt der Einzeller komplett über eine Elektrode ab, an die er Elektronen abgibt. Auch nach Ende des Projekts will Holtmann das Bakterium weiter optimieren, sowohl mittels gerichteter Mutation als auch durch adaptive Laborevolution. „Shewanella hat viele Möglichkeiten und ist molekularbiologisch gut zugänglich“, äußert sich der Forscher zuversichtlich.
Den Machbarkeitsbeweis hat das Projekt außerdem für eine 200-Prozent-Zelle erbracht. Darunter verstehen Elektrochemiker Elektrolyse-Systeme, bei denen an Anode wie an Kathode eine Wertschöpfung erfolgt. Im Regelfall entsteht nur an einer der beiden Elektroden ein Produkt und die andere Reaktion ist lediglich eine chemisch notwendige Gegenreaktion ohne Mehrwert. Hier ist es dem Team jedoch gelungen, ein gekoppeltes System zu entwickeln: An der Anode erzeugte es Octan. Die dabei entstehenden Gase Wasserstoff und Sauerstoff nutzt ein Organismus an der Kathode, um dort Isopropanol zu bilden. Als Kohlenstoffquelle dient ihm CO2. „Wir haben zwei Reaktionen, die gut funktionieren, die feinjustiert und sehr gut einsetzbar sind“, resümiert Holtmann. „Jetzt wollen wir das System skalieren, um es industrienah zu bringen.“ Ökonomisch attraktiv ist eine solche 200-Prozent-Zelle allemal, da sie eine sehr hohe Energieeffizienz aufweist.
Industrienaher Prozess mit Gasdiffusionselektrode
Schon heute industrienah ist der vierte Schwerpunkt des Projekts, die Entwicklung eines mikrobiellen Prozesses mit einer Gasdiffusionselektrode. Darin soll aus CO2 der Kunststoff Polyhydroxybuttersäure (PHB) erzeugt werden. Diese Form der Elektrode ist besonders interessant, da sich Kohlendioxid in wässrigen Medien schlecht löst. In diesem Verfahren wird das Gas jedoch schon in der Elektrode selbst elektrochemisch zu Ameisensäure umgesetzt, während es dort hindurchströmt. In der Flüssigphase setzen dann Mikroorganismen die Ameisensäure um zu PHB. „Wir wollen das Verfahren in einem Folgeprojekt noch weiter verbessern“, sagt Holtmann, „aber es ist schon jetzt sehr gut skalierbar und sehr effizient“.
Insgesamt war das Projekt MES 2.0, das vom Bundesforschungsministerium mit rund 1,25 Mio. Euro gefördert wurde, aus Holtmanns Sicht sehr erfolgreich. Es gehen nicht nur mehrere Publikationen in hochrangigen Fachjournalen darauf zurück. „Wir können auch der Industrie etwas für heute anbieten, ebenso wie Ideen für die Zukunft“, betont der Biotechnologe. „Außerdem haben wir die Möglichkeiten und Grenzen der mikrobiellen Elektrosynthesen aufgezeigt.“
Autor: Björn Lohmann