Wie Enzyme Biowasserstoff herstellen
Bochumer Biochemiker haben einen wichtigen Schritt bei der Herstellung von Wasserstoff durch Enzyme geklärt.

Forscher arbeiten seit Jahren daran, Wasserstoff als Energieträger der Zukunft zu etablieren, um so eine Alternative zu Kohle oder Erdgas zu schaffen. Ein vielversprechendes Werkzeug zur Herstellung des Energiespeichers sind Enzyme. Die Supertalente der Bioindustrie können chemische Reaktionen entsprechend beeinflussen. „Um Wasserstoff in industriellem Maßstab mithilfe von Enzymen zu erzeugen, müssen wir deren Funktionsweise genau verstehen“, betont Thomas Happe von der Ruhr-Universität Bochum.
Hydrogenasen agieren in zwei Richtungen
Gemeinsam mit seinen Teamkollegen Martin Winkler ist es Happe gelungen, den entscheidenden Katalyseschritt bei der sogenannten Hydrogenase zu klären. Wie die Wissenschaftler im Fachjournal „Nature Communications“ berichten, haben Hydrogenasen das Talent in zwei Richtungen zu arbeiten. So können sie Protonen und Elektronen zu Wasserstoff umsetzen aber auch Wasserstoff in Protonen und Elektronen spalten. Beide Reaktionen finden jeweils im aktiven Zentrum der Hydrogenase statt, im sogenannten H-Cluster, das eine komplexe Struktur aus sechs Eisen- und sechs Schwefelatomen ist. Während des Katalyseprozesses durchläuft dieser Cluster dabei mehrere Zwischenzustände, wie die Bochumer Forscher herausfanden.
Bei der Spaltung von molekularem Wasserstoff (H2) bindet das Wasserstoffmolekül zunächst an den H-Cluster. Es entsteht ein positiv geladenes Proton (H+) und ein negativ geladenes Hydrid-Ion (H-), die dann schnell zu zwei Protonen und zwei Elektronen weiterreagieren. „Der Hydrid-Zustand des aktiven Enzyms, in dem also das Hydrid-Ion an das aktive Zentrum gebunden ist, gilt als hochgradig instabil – nachweisen konnte ihn bislang niemand“, so Winkler. Das ist dem Team um Happe und Winkler nun gelungen.
Reaktionsmechanismus der Herstellung von Wasserstoff durch Enzyme
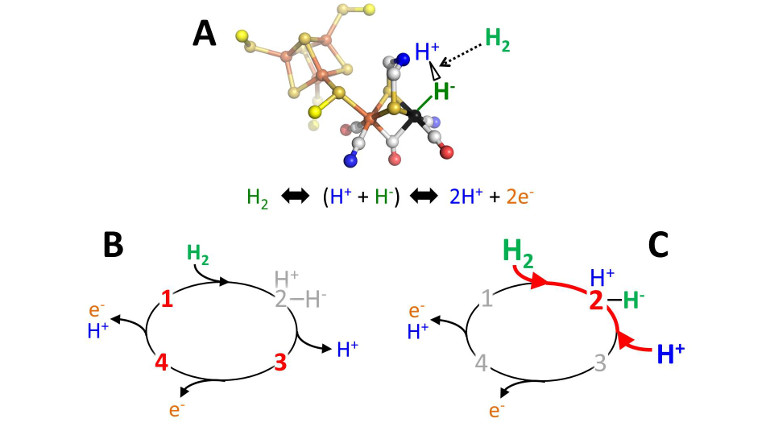
Messbare Zwischenzustände
Um den H-Cluster-Zustand spektroskopisch nachzuweisen und messbar zu machen, bedienten sie sich eines Tricks und reicherten das aktive Zentrum mit einem Hydrid-Ion an. So kam es bei der Wasserstoffspaltung zu einem chemischen Gleichgewicht zwischen Protonen, Hydrid-Ionen und Wasserstoffmoleküle. Durch die Zugabe großer Mengen an Protonen und Wasserstoff zu dem Gemisch wurde das Gleichgewicht schließlich zugunsten der Hydrid-Produktion verschoben, wie die forscher berichten. Das aktive Zentrum mit dem negativ geladenen Hydrid-Ion reicherte sich damit in größerer Menge an, sodass der Zustand messbar wurde.
Grundlage für industrielle Wasserstoffproduktion
„So konnten wir das Katalyseprinzip dieser Hydrogenasen erstmals experimentell belegen. Das liefert eine entscheidende Grundlage, um den hochgradig effektiven Umsatzmechanismus des H-Clusters für die industrielle Erzeugung von Wasserstoff zu reproduzieren“, resümiert Thomas Happe. Bis zu 10.000 Wasserstoffmoleküle pro Sekunde können Enzyme umsetzen. Die Studie der Bochumer Forscher wurde von der Volkswagen-Stiftung und von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Exzellenzclusters Resolv unterstützt.
bb