Mit System zu neuen bioaktiven Stoffen
Herbert WaldmannBeruf:
promovierter Chemiker
Position:
Direktor der Abteilung Chemische Biologie am Max-Planck-Institut für molekulare Physiologie und Professor für Biochemie an der TU Dortmund

Beruf:
promovierter Chemiker
Position:
Direktor der Abteilung Chemische Biologie am Max-Planck-Institut für molekulare Physiologie und Professor für Biochemie an der TU Dortmund

Der Dortmunder Chemiker Herbert Waldmann forscht daran, Naturstoffe so zu vereinfachen, dass sie ihre biologische Funktion behalten und als Ausgangspunkt für die Pharmaforschung dienen können.
Den Zufall durch System ersetzen – so könnte man den Ansatz zusammenfassen, mit dem Herbert Waldmann biologisch aktive Moleküle sucht, die später die Grundlage für medizinische Wirkstoffe bilden könnten. Es ist diese Verbindung aus Biologie und Chemie, die den mehrfach ausgezeichneten Forscher und heutigen Direktor der Abteilung Chemische Biologie am Max-Planck-Institut (MPI) für molekulare Physiologie in Dortmund schon seit seiner Schulzeit begleitet.
Offenheit für neue Gebiete
„Mein Chemie- und Biolehrer hat damals mein Interesse an der Chemie geweckt“, erinnert sich Waldmann. Das Studium der Chemie an der Universität Mainz mit anschließender Promotion in organischer Chemie war die logische Konsequenz. Aus seiner Postdoc-Zeit in Harvard bei George Whitesides hat er die „sehr große Offenheit, sich in neuen Gebieten zu bewegen“ mitgenommen. „Die Amerikaner sind leichtfüßiger, zeigen mehr Risikobereitschaft“, findet er.
Zurück in Mainz habilitiert er sich 1991, übernimmt bald darauf eine Professur für Organische Chemie an der Universität Bonn, wechselt aber bereits 1993 auf den Lehrstuhl für Organische Chemie an der Universität Karlsruhe. Bereits in Bonn interessierte sich der Forscher für den sogenannten Ras-Signalweg, der eine wichtige Rolle bei Tumorzellen spielt. Der Ras-Signalweg ist in gesunden Zellen grundlegend für das Zellwachstum. In Krebszellen ist das Ras-Protein häufig mutiert und führt zu unkontrolliertem Zellwachstum. Fände man eine Substanz, um diesen Signalweg in Tumorzellen zu blockieren, ließe sich auch das Tumorwachstum stoppen, der Tumor vielleicht sogar zerstören. „Wenn ich auf ein neues Thema stoße, das mich interessiert, tauche ich mit einer fast kindlichen Neugier in das Thema ein und lese solange, bis ich alles weiß, was ich wissen will“, hat Waldmann einmal in einem Interview gesagt. Zu Ras hatte er damals nicht lange zu lesen, denn von chemischer Seite war darüber erst wenig geforscht worden.
Pionierarbeit am Ras-Signalweg
Auf der Suche nach einem Partner auf biologischer Seite stößt Waldmann auf Alfred Wittinghofer, einen Pionier der Ras-Forschung, der bereits damals am MPI für molekulare Physiologie arbeitet. Jemandem eine Zusammenarbeit vorzuschlagen in einem Fachgebiet, in dem man nicht selbst forscht, ist ungewöhnlich. Doch er habe sich gedacht: „Frag ihn. Trau Dich!“, erinnert sich Waldmann. Wittinghofer willigt ein. In der Folge der Zusammenarbeit wird Waldmann ebenfalls ans Dortmunder MPI berufen und tritt parallel eine Professur an der TU Dortmund an. Wittinghofers Kollege, der Zellbiologe und heutige Direktor der Abteilung Systemische Zellbiologie Philippe Bastiaens, komplettiert das Trio, das fortan Substanzen gegen Ras erforscht.
Gemeinsam tragen sie zunächst dazu bei, die dynamische Regulierung der Ras-Proteine und damit auch des Ras-Signalwegs zu entschlüsseln, „eine der bis heute spannendsten Entdeckungen, an der wir beteiligt waren“, so Waldmann. Danach gelingt es den Wissenschaftlern, Moleküle zu finden, die den Ras-Signalweg stören – doch immer wieder zeigen sich Probleme, die einen therapeutischen Einsatz verhindern. Aktuell setzen die Forscher ihre Hoffnungen in eine vierte Generation von Blockern des Signalwegs, deren Blockademechanismus – anders als bei der Vorgängergeneration – von den Krebszellen nicht wieder aufgelöst werden kann.
Das Ras-Protein (links oben) und Angriffspunkte für mögliche Wirkstoffe zur Tumortherapie, darunter bestimmte strukturelle Elemente und der Interaktionspartner Raf.
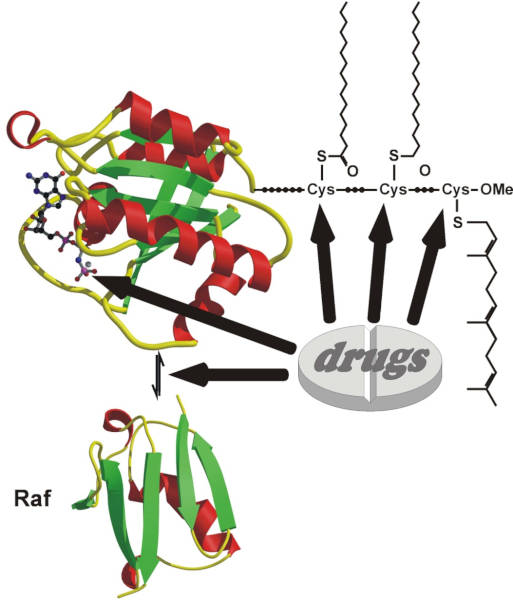
Zufallsmoleküle sind zu selten bioaktiv
Wesentlich für die Arbeit Waldmanns und seines Teams ist der systematische Ansatz, eine Abkehr von den Methoden der 1990er-Jahre. In jener Zeit erzeugten Chemiker automatisiert Hunderttausende unterschiedlicher Verbindungen nach dem Zufallsprinzip und testeten diese auf ihre pharmakologische Wirksamkeit. Doch nur etwa jede hunderttausendste Verbindung zeigte tatsächlich eine biologische Aktivität. Viel zu wenig, denn auf dem Weg zu einem Medikament scheitern die meisten Substanzen. „Es bringt nichts, die Substanzbibliotheken immer weiter aufzustocken“, resümiert Waldmann.
Seitdem richten die Forscher ihren Blick verstärkt auf Naturstoffe, denn diese Substanzen sind oftmals biologisch wirksam – ein Drittel aller Arzneimittel basiert auf Naturstoffen. „Fast alle Antibiotika leiten sich von Naturstoffen ab“, erläutert Waldmann. Allerdings sind diese Stoffe oft komplex aufgebaut, die Synthese im Labor ist schwierig und langwierig und „oft nicht dafür geeignet, Substanzen in großen Mengen für die Industrie zu produzieren“, so Waldmann. Der Biochemiker verfolgt daher einen anderen Ansatz: „Wir analysieren, wie die biologischen Eigenschaften der Naturstoffe in deren Struktur verankert sind“, erklärt er. „Dann versuchen wir daraus Prinzipien abzuleiten.“
Zusammenhänge zwischen Struktur und Aktivität
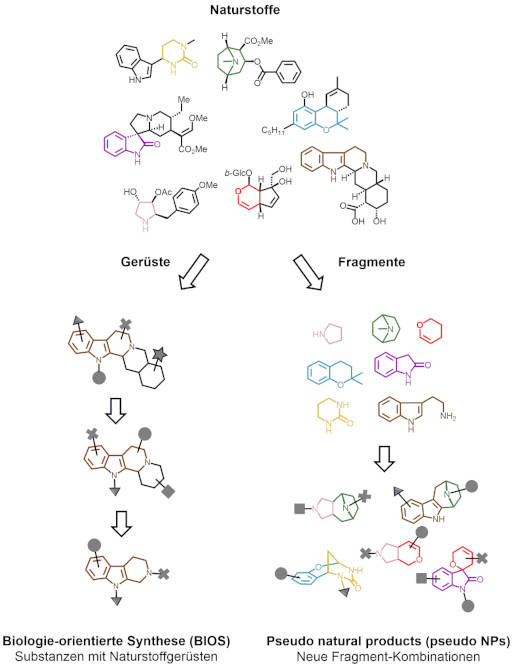
Lassen sich zwischen den Eigenschaften und den Strukturen Zusammenhänge herstellen, versuchen die Wissenschaftler, diese Strukturen mit möglichst einfachen Molekülen nachzubilden – in der Hoffnung, dass diese die gleiche biologische Aktivität aufweisen. Neben Methoden aus der Biochemie, der Organischen Chemie und der Molekularbiologie, hilft den Forschern dabei eine eigens entwickelte Software, der „Scaffold Hunter“, zu deutsch „Gerüstjäger“. Das Programm unterstützt die Chemiker bei der Suche nach erfolgversprechenden Grundgerüsten für die Synthese neuer, einfacher Verbindungen.
Häufig liegt die interessanteste Lösung irgendwo in der Mitte zwischen maximaler Schlichtheit und ursprünglicher Komplexität. An Zellkulturen identifizieren und testen die Forscher dann die Angriffspunkte dieser neuen Moleküle. „Ist der Mechanismus krankheitsrelevant, endet hier die Grundlagenforschung und es beginnt die Wirkstoffforschung“, erläutert Waldmann. Das obliegt in der Regel Partnern aus der Pharmaindustrie.
Neue Prinzipien, nach denen von Naturstoffen inspirierte Wirkstoffkandidaten gefunden werden können: In der Biologie-orientierten Synthese (links) werden grundlegende Naturstoffgerüste identifiziert, die dann die Basis für neue Synthesen bilden. Pseudo-Naturstoffe (rechts) werden durch neue Kombinationen von Naturstofffragmenten erhalten.
Krebszellen gezielt aushungern
Zwei aktuelle Beispiele nennt der Abteilungsdirektor, bei denen sich der Ansatz der Dortmunder als vielversprechend erweist. Der erste betrifft die Tumorforschung. „Krebszellen haben einen hohen Energie- und Nährstoffverbrauch. Verhindern wir die Zuckeraufnahme, können wir den Krebs vielleicht aushungern“, erläutert Waldmann. Die Forscher haben daher Naturstoffe gesucht, die den Glukosetransport in die Zellen verhindern, und aus diesen vereinfachte Substanzen abgeleitet. Ob daraus jemals ein Medikament werden wird, ist noch unklar – aber der Ansatz scheint zu funktionieren.
Ähnlich ist der Ansatz gegen Überreaktionen des Immunsystems, bei denen der Körper zu viele spezialisierte Immunzellen, sogenannte Neutrophile, produziert. Die Teilung dieser Immunzellen benötigt viel Energie, ähnlich wie das Wachstum von Tumoren. „Wir haben eine Substanz gefunden, die diese überschüssige Reaktion zelltypspezifisch verhindern kann“, berichtet Waldmann. Darauf basierend könnten nun neue Therapien entwickelt werden.
Wirkstoffentwicklung braucht ausdauernde Grundlagenforschung
Beteiligt an den Erfolgen sind rund 30 bis 40 Personen, die im Team von Waldmann forschen. „Wir sind sehr breit aufgestellt“, hebt der Abteilungsdirektor hervor. „Ich habe die Erfahrung gemacht, dass es extrem inspirierend ist, nicht nur unter seinesgleichen, sondern unter den anderen, also Biologen, Biochemikern, Biophysikern, zu leben und so ganz neue Impulse zu erhalten“, sagte Waldmann einmal in einem Interview. Heute betont er zudem, dass Grundlagenforschung eine systematische, ausdauernde Arbeit sei; man müsse aber immer auf das Ungewöhnliche vorbereitet sein. Und man brauche damals wie heute beide: Spezialisten und Leute, die neue Erkenntnisse in andere Gebiete übertragen. Als Grenzgänger zwischen Chemie und Biologie lebt Waldmann das seit Jahrzehnten beispielhaft vor.
Autor: Björn Lohmann


