Enzym in Aktion gefilmt
Molekül-Kino: Deutsche und kanadische Strukturbiologen haben ein Enzym bei der Arbeit beobachtet und einen Zeitraffer-Film produziert.
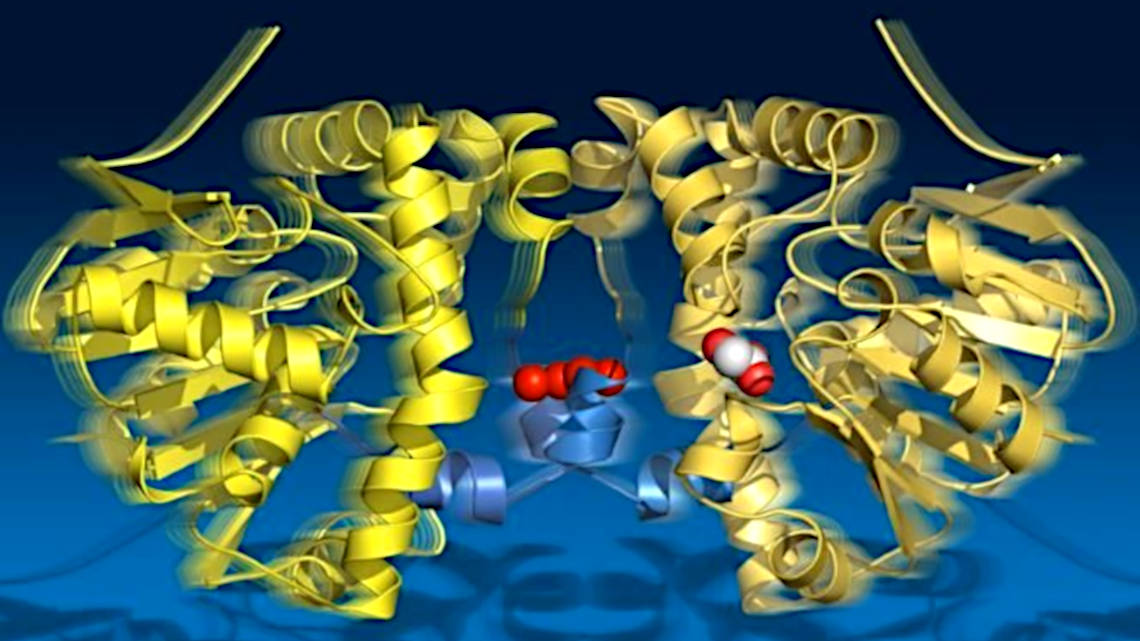
Die Verbindung zwischen einen Fluor- und einem Kohlenstoffatom ist die stärkste Bindung in der organischen Chemie. Sie zu spalten wäre eine Reaktion, die von alleine im Zeitraum von Jahren abläuft, doch manche Enzyme verkürzen die Reaktion auf einige Sekunden. Wissenschaftler des Max-Planck-Instituts für Struktur und Dynamik der Materie (MPSD) in Hamburg, der Universität Potsdam und der University of Toronto in Kanada haben nun in einem hochdetaillierten Zeitrafferfilm dokumentiert, was genau während dieser Reaktion in dem Enzym Fluoressigsäure-Dehalogenase vor sich geht. Im Wissenschaftsjournal „Science“ berichten sie darüber und über ein bis dato unbekanntes Prinzip, das sie dabei entdeckt haben.
18 Schnappschüsse vom Katalyse-Zyklus
Mithilfe der Röntgenkristallographie erzeugten die Forscher 18 Schnappschüsse über 30 Sekunden der Katalyse und erfassten so vier Zyklen mit allen Zwischenzuständen der Reaktion. Die Bilder zeigen, wie zunächst das Substrat gebunden wird, sich ein Zwischenprodukt bildet, ein hydrolytisches Wassermolekül bereitgestellt wird und schließlich das Reaktionsprodukt das Enzym verlässt.
Eine Signalkette aus Wassermolekülen
Die Forscher beobachteten außerdem, dass das Enzym gewissermaßen „atmet“: Es dehnt sich im Rhythmus der Teilschritte aus und zieht sich wieder zusammen. Dabei bleiben die beiden Hälften des Enzyms über eine Verbindungsschnur von Wassermolekülen in Kontakt. Offensichtlich erfährt dadurch jede Hälfte den jeweils aktuellen katalytischen Zustand der anderen Hälfte. Für die Reaktion ist das von großer Bedeutung, da immer nur eine Hälfte des Enzyms zur Zeit katalytisch aktiv sein kann.
Bedeutung für Klimaschutz und Umweltsanierung
Die Wissenschaftler haben sich besonders für die Verbindung zwischen Fluor und Kohlenstoff interessiert, weil sie eine hohe Relevanz für den Treibhauseffekt haben. Außerdem spielt diese Verbindung eine wichtige Rolle in Materialien wie Teflon und GoreTex, in pharmazeutischen Produkten und Pestiziden. Das Ziel der Studie war es daher, die enzymatische Spaltung derartiger Verbindungen zunächst zu verstehen und idealerweise aktiv steuern zu können.
Die jetzt beobachteten dynamischen Bewegungen des Enzyms dürften zudem nach Einschätzung der Wissenschaftlern in vielen anderen enzymatischen Katalysen Entsprechungen besitzen.
bl


