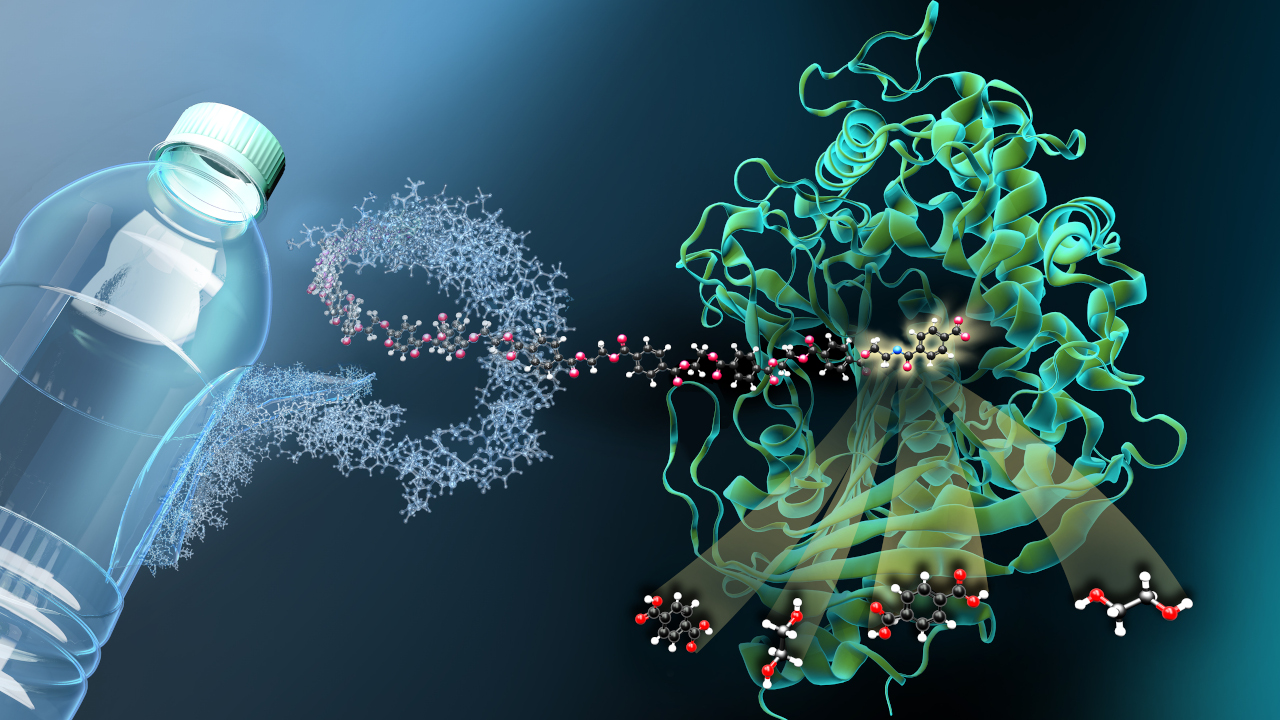
Biosynthese nach Maß
Frankfurter Forscher haben einen wichtigen Schritt der Peptid-Synthese entschlüsselt und sind dem Ziel maßgeschneiderter Peptide damit nähergekommen.

Peptide, auch Naturstoffe genannt, sind die Grundbausteine von Proteinen und werden nicht nur von unseren Zellen, sondern auch von Mikroorganismen wie am Fließband zusammengebaut. Als Grundbausteine von Proteinen, die wiederum unter anderem das Gerüst für zahlreiche Enzyme und medizinische Therapeutika sind, ist ihr Potenzial enorm. Vor allem die Pharma- und Kosmetikindustrie setzen deshalb immer mehr auf Peptide aus mikrobieller Herkunft. Diese Multitalente für den industriellen Einsatz maßzuschneidern, ist daher erklärtes Ziel vieler Forscher. Ein Team um Jens Wöhnert und Helge Bode von der Goethe-Universität Frankfurt am Main ist nun auf diesem Weg einen großen Schritt vorangekommen. Wie die Forscher im Fachjournal „Nature Communications“ berichten, konnten sie sowohl die Struktur als auch die Funktion sogenannter Docking-Domänen – wichtige Zwischenschritte bei der Peptid-Biosynthese – entschlüsseln.
Spezielle Enzyme kurbeln Peptidproduktion an
Bei der Peptidbildung sind Mikroorganismen auf die Hilfe spezieller Enzyme angewiesen. Diese nicht-ribosomalen Peptid Synthetasen (NRPS) sind dafür verantwortlich, dass die Peptide wie am Fließband zusammengesetzt und produziert werden. Vergleichbar mit der Montage eines Autos sind die NRPS an hintereinander geschalteten Stationen dafür verantwortlich, dass jeweils eine bestimmte Aminosäure eingebaut und prozessiert wird, bis am Ende ketten-, ringförmige oder anders modifizierte Peptide entstehen. Vor allem bei der Bildung größerer Petide kommen mehrere dieser speziellen NRPS-Schlüsselstellen nacheinander zum Einsatz – je größer das Peptid, desto mehr NRPS-Stellen. Die Reihenfolge dieser NRPS' wird von sogenannten Docking-Domänen bestimmt, die die einzelnen NRPS-Abschnitte im Schlüssel-Schloss-Prinzip aneinanderfügen. Die Passgenauigkeit der Andockstellen ist dabei entscheidend für die erfolgreiche Biosynthese der Peptide,
Wechselwirkung von Docking-Domänen geklärt
„Wir konnten die Strukturen von einzelnen Docking-Domänen und erstmals auch eines Docking-Domänen-Paars von NRPS bestimmen“, erläutert Carolin Hacker, Doktorandin in der Arbeitsgruppe von Jens Wöhnert. „So war es möglich, die Regeln für die Wechselwirkung der Docking-Domänen aufzuklären und diese so zu verändern, dass neue Naturstoffe gebildet werden“, fügt Xiaofeng Cai, Postdoktorandin in der Arbeitsgruppe von Helge Bode hinzu.
Biosynthesewege verknüpfen
Auch wenn die ersten Ergebnisse zu den Docking-Domänen vielversprechend sind: Der Weg zu maßgeschneiderten Naturstoffen ist noch weit. „Wir brauchen Strukturen weiterer und strukturell unterschiedlicher Docking-Domänen, um diese schließlich wie einen Baukasten zu verwenden. Unser Ziel ist es, verschiedene Biosynthesewege zu verknüpfen und so ganz neue Wirkstoffe herzustellen“, erklärt Wöhnert. „Die Natur war da sehr erfinderisch und es gibt offensichtlich viele unterschiedliche Möglichkeiten, diese komplexen Enzyme zur Zusammenarbeit zu überreden“, ergänzt Bode.
bb