Vor 10.000 Jahren hat der Mensch begonnen, Wildpflanzen auszuwählen und sie nutzbar zu machen und anzubauen. Systematisch und gezielt gehen Pflanzenzüchter erst seit rund einhundert Jahren vor. Am Grundprinzip hat sich dabei nicht viel geändert: Der Mensch greift in die Evolution der Pflanzen ein, beschleunigt sie und richtet sie für seine Zwecke aus.
Um zu neuen Sorten zu gelangen, sind dafür drei Schritte zentral: zunächst geht es darum, die genetische Vielfalt zu erhöhen (Variation) – zum Beispiel durch Kreuzen und künstlich ausgelöste Veränderungen im Erbgut. Unter den Nachkommen werden dann diejenigen mit gewünschten Eigenschaften ausgewählt (Selektion). Die so per Auslese gewonnenen Pflanzen werden dann weiter vermehrt und auf zuverlässige Eigenschaften geprüft – am Ende steht eine neue Sorte. Auf dem Weg dahin verwenden Pflanzenzüchter heute meist einen Mix aus Methoden und Techniken. Dieses Dossier gibt einen Überblick über Klassiker und vielversprechende Neuzugänge in der Werkzeugkiste.
Wofür verwendet: Kreuzungen dienen der genetischen Kombination von interessanten Eigenschaften verschiedener Pflanzen einer Art.
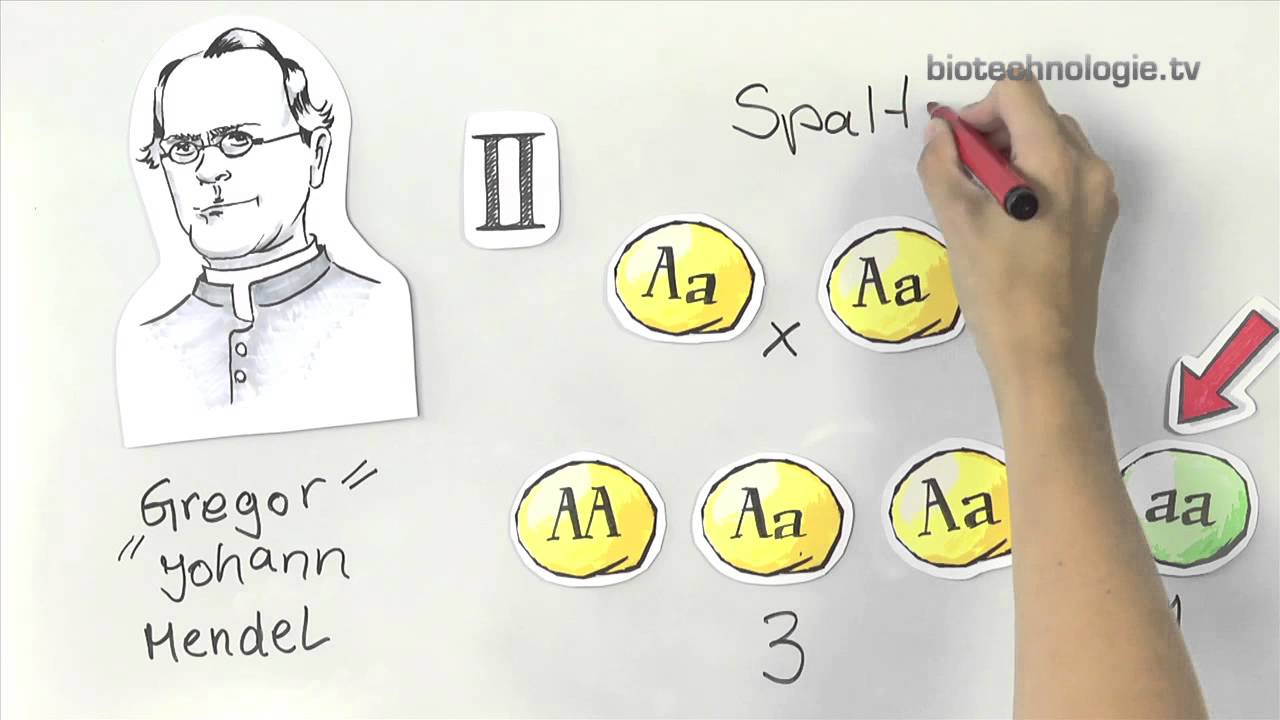
So funktioniert es: eine Kreuzung ist die gezielte Paarung von zwei genetisch verschiedenen Pflanzen einer Art. Man bringt den „männlichen“ Pollen einer Elternpflanze auf die Narbe des „weiblichen“ Fruchtknotens einer anderen Elternpflanze. Durch die Bestäubung und die Befruchtung entstehen in den Samenanlagen Nachkommen, die einen neukombinierten Mix der vollständigen Genome der Eltern in sich vereinigen. Interessante Merkmale tauchen dabei in der Nachkommenschaft nach bestimmten Mustern auf – den Mendelschen Vererbungsregeln. Als Ausgangsmaterial für Kreuzungen stützen sich die Züchter auf Zuchtlinien, die möglichst reinerbig ist. Reinerbig werden Linien, die durch Selbstbefruchtung erzeugt wurden.
Seit wann eingesetzt: Entdeckt hat die Regeln der natürlichen Vererbung der Augustinermönch Gregor Mendel in der Mitte des 19. Jahrhunderts. Erst im Jahr 1900 wurden die Mendelschen Regeln wiederentdeckt, und seither auch gezielt und systematisch in der Pflanzenzüchtung eingesetzt.
Schwachpunkte: Die systematische Kreuzungszüchtung ist je nach Nutzpflanze sehr aufwendig und es dauert viele Jahre, die Nachkommen von Kreuzungen phänotypisch auf ihre Eigenschaften zu prüfen und die besten Kandidaten für eine Zuchtlinie auszuwählen. Außerdem gilt die natürliche Grenze: Man kann nur innerhalb einer Pflanzenart Individuen miteinander kreuzen. Liegen zwei Merkmale im Erbgut sehr dicht benachbart, ist es nahezu unmöglich, diese miteinander auf diesem Weg in einer Nachkommen-Pflanze zu vereinigen.
Bedeutung: Bis heute sind Kreuzungen das grundlegende Werkzeug der Pflanzenzüchter. Durch die Kreuzungszüchtung hat zu enormen Ertragssteigerungen bei allen Nutzpflanzen geführt. Ihr Beitrag zum Ertragsfortschritt aller Kulturarten wird auf bis zu 35% geschätzt.
Wofür verwendet: Man kombiniert genetisch möglichst unterschiedliche, aber reinerbige Zuchtlinien und erhält eine besonders leistungsfähige und ertragreiche Nachkommen-Generation – sogenannte Hybride.
So funktioniert es: Die Hybridzüchtung beruht auf Kreuzungen. Das Besondere sind die Elternpflanzen als Ausgangsmaterial: es werden sogenannte Inzuchtlinien verwendet, die Gewächse wurden über etliche Generationen selbstbefruchtet. Sie sind daher reinerbig. Je unterschiedlicher die Vater- und die Mutterlinie in ihren genetischen Eigenschaften sind, desto besser. Denn dann ist der natürliche Heterosiseffekt umso ausgeprägter: Die Nachkommen – die Hybridgeneration – sind besonders kräftig im Wuchs, widerstandsfähiger und ertragreicher. Der Heterosiseffekt ist nur auf die Hybridgeneration beschränkt. Bereits bei den Nachkommen der Hybridpflanzen geht der Effekt verloren. Dafür verantwortlich ist die Spaltung der Generation nach dem zweiten Mendelschen Gesetz.
Seit wann eingesetzt: Die US-Botaniker Georg Shull und Edward Murray East haben den Heterosiseffekt zu Beginn des 20. Jahrhunderts entdeckt. Er wird seit 1920 erfolgreich in der Pflanzenzüchtung eingesetzt. Wie er im Detail entsteht, ist bis heute noch nicht völlig klar.
Schwachpunkte: Hybrid-Saatgut muss wegen der oben beschriebenen Verlust des Heterosiseffekts immer wieder neu hergestellt werden. Beim getrenntgeschlechtlichen und fremdbestäubten Pflanzen wie Mais oder Zuckerrübe ist das Verfahren gut etabliert, da man hier die Mutterpflanzen leicht kastrieren kann. Bei Weizen, einem Zwitter, ist die Hybridzüchtung hingegen äußerst aufwendig, da man hier mit sogenannten männlich-sterilen Mutterpflanzen arbeiten muss.
Bedeutung: Hybridsorten sind so etwas wie der Turbo der Pflanzenzüchter: Viele Hochleistungssorten setzen heute auf den Heterosiseffekt. Hybridsorten haben maßgeblichen Anteil an den enormen Ertragssteigerungen bei Nutzpflanzen. So hat die Einführung von Hybridmais in den 1930er Jahren die Erträge im Vergleich zu den bis dahin verwendeten reinerbigen Sorten um mehr als 200% erhöht. Für die Züchtungsbetriebe hat das Hybrid-Saatgut einen weiteren wirtschaftlichen Vorteil: Hybridsorten lassen sich nicht nachbauen und gewährleisten somit einen weitgehenden Schutz des geistigen Eigentums ihres Züchters.
Wofür verwendet: Mithilfe chemischer oder physikalischer Tricks werden zufällige Veränderungen im Erbgut ausgelöst, um damit schneller zu genetischer Vielfalt und zu Pflanzen mit neuen Eigenschaften zu kommen.
So funktioniert es: Das Genom von Pflanzen verändert sich in der Natur ständig. Natürliche Mutagenese ist aber ein langsamer und seltener Prozess. Mithilfe von Chemikalien oder Strahlung lässt sich die Häufigkeit, mit der Veränderungen im Erbgut (Mutationen) entstehen, deutlich erhöhen. Man lässt diese sogenannten Mutagene auf die Samen der Pflanzen einwirken, damit dort in den Zellen der Keimbahn Mutationen entstehen, die an kommende Generationen weitervererbt werden. Mit Chemikalien werden meist Veränderungen in einzelnen Buchstaben des DNA-Codes ausgelöst (Punktmutationen). Die Effekte von Gamma- oder Neutronenstrahlung sind tiefgreifender: hier entstehen Brüche im DNA-Doppelstrang. Manchmal gehen ganze Chromosomenabschnitte verloren. Die natürliche Genreparatur der Zelle sorgt dafür, dass das Erbgut trotzdem intakt bleibt. Anschließend werden die entstandenen Mutanten auf interessante genetische Eigenschaften durchsucht. Diese werden dann in vorhandene Sorten eingekreuzt.
Seit wann eingesetzt: Seit den 1930er Jahren eingesetzt. Zwischen 1965 und 1990 ist die durch atomare Strahlung ausgelöste Mutagenese systematisch in der Pflanzenzüchtung eingesetzt worden.
Schwachpunkte: Die klassische Mutagenese wirkt zufällig: ungerichtet werden in einer Zelle oft an vielen Stellen gleichzeitig im Erbgut Brüche induziert. Den Züchter interessiert aber meist nur eine einzige Mutation und deren Auswirkung auf die Eigenschaften einer Pflanze. Die Züchter kommen daher nicht umhin, durch vielfache Kreuzungen das Erbgut der Pflanzenlinie zu „reinigen“. Durch sogenanntes Auskreuzen oder Rückkreuzen lassen sich die ungewünschten Veränderungen nach und nach aus dem Erbgut verdrängen.
Bedeutung: Ein großer Teil der gängigen Gemüsesorten basiert auf Mutationszüchtung – auch die Kurzhalmigkeit der Gerste wurde so erzeugt. Nach einer Aufstellung der Internationalen Atomenergiebehörde sollen etwa 1.800 neue mit dieser Methode erzeugte Pflanzensorten auf den Markt gekommen sein. In der EU gibt es für neue, aus der Mutationszüchtung hervorgegangene Pflanzen keine besonderen Bestimmungen. Anders als gentechnisch veränderte Pflanzen müssen diese kein Zulassungsverfahren durchlaufen.
Wofür verwendet: Dank der Regenerationsfähigkeit von Pflanzenzellen lässt sich im Biotechnologie-Labor Gewebe vermehren und zerteilen. So entstehen genetisch identische Ableger – Klone – aus denen jeweils wieder komplette Pflanzen werden können.
So funktioniert es: Pflanzenzellen besitzen außergewöhnliches Entwicklungspotenzial. Besonders in den Bildungsgeweben an der Sprossspitze und den Achselknospen, den Meristemen, sitzen teilungsfähige Zellen. Aus ihnen kann wieder eine vollständige Pflanze werden, wenn man sie mit einem bestimmten Hormon-Cocktail behandelt. Mithilfe dieser In-vitro-Vermehrung, werden Klone in der Petrischale hergestellt. Aus den Klonen lassen sich erbgleiche, vollständige Pflanzen regenerieren. Diese Zelltechnik wird auch somatische oder In-vitro-Embryogenese genannt. Gewebekultursysteme nutzen die Züchter auch, um aus haploidem Pollengewebe der Pflanzen reinerbige diploide Pflanzen zu regenerieren (doppelt-haploide Pflanzen). Damit sparen sie die ansonsten sehr aufwendigen Rückkreuzungsschritte für die Erzeugung homozygoter Pflanzen.
Seit wann eingesetzt: Der Pflanzenanatom Gottlieb Haberlandt legte 1902 die Grundlagen für die moderne Pflanzengewebekultur. Ende der 1950er fanden die Erkenntnisse von Forschern weltweit Eingang in die Pflanzenzüchtung.
Schwachpunkte: Es braucht speziell ausgestattete Biotechnologie-Labore und entsprechendes Fingerspitzengefühl, auch die Regeneration der Gewebe ist aufwendig.
Bedeutung: Diese Technik eignet sich besonders zur Vermehrung von Pflanzen, die über andere Wege schwer zu vermehren sind. Zellkulturtechniken werden auch in der Erhaltungszüchtung von vegetativ vermehrten Arten wie der Kartoffel oder der Erdbeere eingesetzt. Diese Arten werden im Freiland häufig von Krankheitserregern befallen. Die Vermehrung über Zellkulturverfahren gewährleistet eine gesunde Nachkommenschaft. Bei Zierpflanzen hat die klonale Massenvermehrung tropische Orchideen erst erschwinglich gemacht. Auch bei Obstgehölzen und Nadelbäumen wie der Nordmanntanne wird die In-vitro-Vermehrung angewandt und erprobt.
Wofür verwendet: Mithilfe verschiedener molekularbiologischer Methoden wird ein ausgesuchtes Gen oder genetisches Material in Nutzpflanzen eingeführt. So werden wertvolle Eigenschaften übertragen, die stabil an Nachkommen weitergegeben werden können.
So funktioniert es: Durch die sogenannte Grüne Gentechnik werden Pflanzenzellen in die Lage versetzt, ein neu in ihr Erbgut eingeführtes Gen zu produzieren. Das kann ein fremder DNA-Abschnitt aus einer anderen Pflanzenart sein oder sogar von Tieren oder sogar den Menschen stammen – denn der genetische Code ist universell. Ein wichtiger Schritt in diesem Verfahren ist der Gentransfer, durch den das fremde Erbmaterial in die Zelle eingeschleust wird: dafür werden in erster Linie Agrobakterien als Einschleuser verwendet. Die Bodenmikrobe Agrobacterium tumefaciens hat in der Evolution Tricks entwickelt, an Pflanzenzellen anzudocken und dann einen DNA-Ring ins Innere der Zelle zu bugsieren. Biotechnologen haben diesen DNA-Ring für seinen Einsatz als Gen-Taxi optimiert. Im Zellkern nimmt der natürliche Prozess der nicht-homologen Rekombination seinen Lauf: das neue Erbmaterial wird an einer zufälligen Stelle in das Genom eingebaut. In der Regel bleibt diese Prozedur für die Pflanze ohne negative Auswirkungen. Mithilfe molekularbiologischer Verfahren lässt sich nachweisen, wo genau das eingefügte Gen im Erbgut gelandet ist. Durch den Gentransfer entstehen sogenannte transgene Pflanzen. Man spricht von gentechnisch veränderten Organismen – GVO (genetically modified organisms, GMO). Sie werden in Deutschland im Gentechnikgesetz reguliert.
Seit wann eingesetzt: Der Siegeszug der Gentechnik bei Mikroorganismen begann in den 1970er Jahren. Nach der Entschlüsselung der molekularen Grundlagen des Gentransfers von Agrobakterien wurde 1983 die erste transgene Tabakpflanze hergestellt. Der kommerzielle Anbau von gentechnisch veränderten Nutzpflanzen begann 1996 – Monsanto brachte eine Sojabohne auf den Markt, die gegen das Herbizid Glyphosat resistent ist.
Schwachpunkte: Ein mögliches ökologisches Risiko: Der Pollen von Gentechnik-Pflanzen kann potenziell auf Nachbarfelder gelangen oder in verwandte Arten oder Wildarten auskreuzen. Die Schädlinge, gegen die gv-Pflanzen gerichtet sind, können Resistenzen entwickeln – ein auch in der konventionellen Züchtung unvermeidliches Phänomen, das der Evolution geschuldet ist. Für Gesundheitsrisiken (etwa Allergien, Krebs oder Diabetes) durch den Verzehr von gentechnisch veränderten Lebensmitteln aus Pflanzen hat die Wissenschaft und die relevanten Kontrollbehörden wie auch die WHO bisher keine überzeugenden Hinweise gefunden. Gleichwohl bleibt der Einsatz Grüner Gentechnik auf dem Acker gesellschaftlich umstritten und stößt besonders in Europa auf geringe Akzeptanz bei Verbrauchern und der Politik. Eine Sorge gilt auch der zunehmenden Konzentration der Gentechnik-Aktivitäten auf wenige große, internationale Saatgutkonzerne.
Bedeutung: Durch die Übertragungsmöglichkeiten über die Grenzen einer Art hinweg lässt sich die biologische Vielfalt durch Gentechnik für die Landwirtschaft besser nutzen. Neue Eigenschaften müssen nicht mehr nur ausschließlich aus dem begrenzten Genvorrat derselben Pflanzenfamilie genutzt werden, sondern können beispielsweise von anderen Pflanzen oder aus Bakterien stammen. Am häufigsten werden Mais, Soja, Baumwolle und Raps als gentechnisch veränderte Sorten angebaut. Sie tragen zumeist entweder eine Herbizidtoleranz (etwa für Glyphosat) oder eine Resistenz gegen Schadinsekten auf Basis des Bt-Proteins, eine Vorstufe eines Toxins, das erst im Darm von Insekten seine giftige Wirkung entfaltet. Das bedeutet eine gezieltere Bekämpfung von Schädlingen, die Einsparung von Pflanzenschutzmitteln und anderer Agrarchemie und geringere Ernteverluste. Eine neue Generation von gentechnisch veränderten Pflanzen setzt auf das Hinzufügen von Inhaltsstoffen, die die Nahrungs- oder Futterqualität steigern sollen.
Für die Zulassung von Gentechnik-Pflanzen für den Anbau gelten äußerst hohe Sicherheitsstandards und aufwendige Prüfungen durch Kontrollbehörden. 2016 wurden weltweit auf 185 Millionen Hektar Ackerfläche gentechnisch veränderte (gv) Nutzpflanzen angebaut. Die wichtigsten Anbauländer sind die USA, Brasilien, Argentinien, Indien und China. Von hier werden die gentechnisch veränderten Ernteprodukte in alle Welt exportiert. Rund 60 gv-Pflanzensorten sind für den Import in die EU zugelassen. Angebaut werden in Europa gv-Pflanzen jedoch kaum – Spanien bildet hier die Ausnahme.
Mehr Informationen zum Thema Grüne Gentechnik
Wofür verwendet: Molekulardiagnostische Werkzeuge erlauben es, wesentlich schneller im Züchtungsprozess zu erkennen, ob eine Pflanze interessante Merkmale in ihrem Erbgut trägt oder nicht und entsprechend auszuwählen. Der Erbgut-Check ist die Basis für die Präzisionszüchtung.
So funktioniert es: Wollen Züchter etwa bei Tomaten zwei interessante Eigenschaften in einer Sorte vereinen, müssen sie aufwendig hunderte Kombinationen ausprobieren. Überprüfen lässt sich der Züchtungserfolg erst, wenn die Nachkommen selbst Früchte tragen. Die Genomforschung hat hier neue Wege eröffnet, die Zeit und Aufwand spart: Forscher kennen mittlerweile viele Markierungen im Erbgut der Pflanzen, die auf erwünschte Eigenschaften hinweisen. Molekulare Marker sind DNA-Abschnitte, deren Lage auf den Chromosomen bekannt ist. Besonders interessant sind sie, wenn sie nur einmal im Genom vorkommen und in der Nähe von Genen liegen, die für eine Eigenschaft verantwortlich sind. Es gibt zahlreiche Markertypen. Mithilfe einer DNA-Analyse im Labor lassen sie sich meist leicht aufspüren. Dieser Test funktioniert ähnlich wie ein genetischer Fingerabdruck. Die Fachleute sprechen von markergestützter Selektion (MAS).
Seit wann eingesetzt: Die Entwicklung von molekularen Markern begann in den 1980er Jahren. Das Feld profitiert von den Fortschritten bei den DNA-Sequenzierungstechnologien und der Genomforschung.
Schwachpunkte: Die Entwicklung guter molekularer Marker ist immer noch aufwendig und erfordert eine entsprechende Labor-Infrastruktur, IT und Know-how für die statistische Auswertung.
Bedeutung: Der Erbgut-Check ist zwar ein molekularbiologisches Verfahren, ist aber nicht invasiv, also ein reines Diagnose-Verfahren. Molekulare Marker sind einfach handhabbare, günstige und zuverlässige Werkzeug, die sich auch für große Testreihen eignen. Die Züchter müssen beim Smart Breeding nicht mehr warten, bis die Pflanzen ausgewachsen sind. Stattdessen können sie in großen Testanlagen bereits aus Keimlingen DNA gewinnen und diese nach den relevanten Markern absuchen. Das beschleunigt die Züchtung enorm. Besonders die Resistenz-Züchtung stützt sich heute in großem Maße auf molekulare Marker, etwa bei Kartoffeln oder Sonnenblumen. Pflanzenbetriebe setzen Marker routinemäßig zur Qualitätssicherung und für die Züchtung ein.
Wofür verwendet: Mithilfe programmierbarer Genomscheren lässt sich Erbinformation in lebenden Pflanzenzellen gezielt schneiden und verändern – ein Verfahren, das Genome Editing genannt wird. Mit den präzisen Schneide-Enzymen lassen sich gezielt Gene ab- oder anschalten, einfügen oder entfernen.
So funktioniert es: Es kommen präzise Genomscheren zum Einsatz, sogenannte Designer-Nukleasen. Besonders das genchirurgische Werkzeug namens CRISPR-Cas revolutioniert derzeit die Molekularbiologie. Dieses Enzym, das Forscher als eine Art Immunsystem bei Mikroben fanden, besteht aus zwei Komponenten: Einer DNA-Code-Aufspür-Einheit und einer Scherenfunktion. Der Clou: die Schere kann mithilfe einer Erkennungssequenz darauf programmiert werden, ein bestimmtes Ziel im Genom von Organismen anzusteuern und dort einen Schnitt zu setzen. Die zurzeit von der großen Mehrheit der Forscher eingesetzte Anwendung ist es, spezifisch einzelne Gene, die für bestimmte unerwünschte Eigenschaften verantwortlich sind, auszuschalten. Dies erreicht man, indem man einen einzigen spezifischen Schnitt setzt, also mittels CRISPR-Cas einen Doppelstrangbruch in der DNA des jeweiligen Gens verursacht. Der Bruch wird dann wie jeder andere Erbgut-Schaden auf natürliche Art von der Pflanze repariert. Da die Reparatur oft fehlerhaft verläuft, führt dies häufig zur Zerstörung der Genfunktion. Daneben gibt es mithilfe von CRISPR-Cas auch die Möglichkeit, gezielt fremde DNA an spezifischen Stellen des Genoms zu integrieren. Eine weitere Besonderheit: man kann mehrere solcher gezielten Eingriffe gleichzeitig in einem Versuchslauf vornehmen. Bereits einige Jahre vor der Entdeckung des populären CRISPR-Cas-Systems waren andere Designer-Nukleasen entwickelt worden, zum Beispiel die sogenannten TAL-Effektor-Nukleasen (TALEN) oder die Zinkfingernukleasen (ZNF).
Seit wann eingesetzt: Im Jahr 2012 stellten Forscherinnen die Genomschere CRISPR-Cas erstmals im Fachjournal Science vor. Seither hat das molekulare Präzisionswerkzeug die Molekularbiologie revolutioniert.
Schwachpunkte: Auch die Genschere muss erst an den Einsatzort ins Zellinnere gelangen, was Pflanzenforscher derzeit noch mit gentechnischen Verfahren wie den Agrobakterium-vermittelten Gentransfer lösen. Aber es wird bereits an nicht-invasiven Verfahren geforscht. Manchmal kommt es zu irrtümlichen Schnitten, den sogenannten Off-Target-Effekten. Inzwischen wurden verbesserte CRISPR-Cas-Systeme entwickelt, bei denen ungewollte Schnitte die Ausnahme und nicht die Regel sind. Durch moderne Sequenziertechniken ist es auch relativ einfach zu prüfen, ob solche Effekte auftreten. Man kann so nur solche Pflanzen auswählen, bei denen diese Effekte nicht aufgetreten sind. Da die klassischen Mutagenese-Technologien massiv ungewollte Mutationen hervorrufen, ist dieses Problem für den Züchter allerdings im Gegensatz zu medizinischen Anwendungen eher von sekundärer Bedeutung. Die Pflanzenzüchter kreuzen die unerwünschten Mutationen einfach über etliche Pflanzen-Generationen heraus.
Bedeutung: Das Ausschalten von einzelnen Genen mittels Genome Editing kann für die Landwirtschaft zu einer ganzen Reihe von neuen oder attraktiven Eigenschaften führen. Erstmals ist so etwas wie eine gezielte Mutagenese möglich. So konnte bereits mehltauresistenter Weizen erzeugt werden, ebenso wie Soja, aus dem Öl mit einer veränderten Zusammensetzung an ungesättigten Fettsäuren gewonnen werden kann. Auch wurde Mais mit veränderter Stärke-Zusammensetzung hergestellt. In den USA sind bereits genom-editierte Pflanzen für den kommerziellen Anbau zugelassen, in Europa haben sich die Gesetzgeber noch nicht auf die Regulierung dieser Pflanzen festgelegt. Das Problem: Genome Editing ist ein gentechnisches Verfahren - hinterlässt aber keine Spuren im Erbgut bis auf die ausgelösten Punktmutationen. Diese unterscheiden sich aber nicht von natürlich ausgelösten Mutationen. Viele Experten sind daher der Meinung, die mithilfe von CRISPR-Cas gezüchteten Pflanzen sollten nicht unter die Gentechnik-Regulierung fallen.
Mehr Informationen zum Thema Pflanzenzüchtung:
Redaktion: Philipp Graf