CRISPR-Zufallsfund mit Potenzial für Biotech-Innovationen
Ein neu entdeckter CRISPR-Mechanismus versetzt Bakterien gezielt in einen Ruhezustand und verhindert so die Vermehrung von Viren. Die Erkenntnisse könnten neue Anwendungen in der Diagnostik ermöglichen und die Bioökonomie weiter voranbringen.
CRISPR/Cas-Systeme gelten als eine der Schlüsseltechnologien der Bioökonomie. Sie ermöglichen es, biologische Prozesse gezielt zu beeinflussen, etwa für eine nachhaltigere Landwirtschaft, innovative biobasierte Produktionsverfahren oder neue diagnostische Anwendungen. Neue wissenschaftliche Erkenntnisse erweitern dieses Potenzial nun.
Ein neuer CRISPR-Mechanismus legt Zellen gezielt lahm
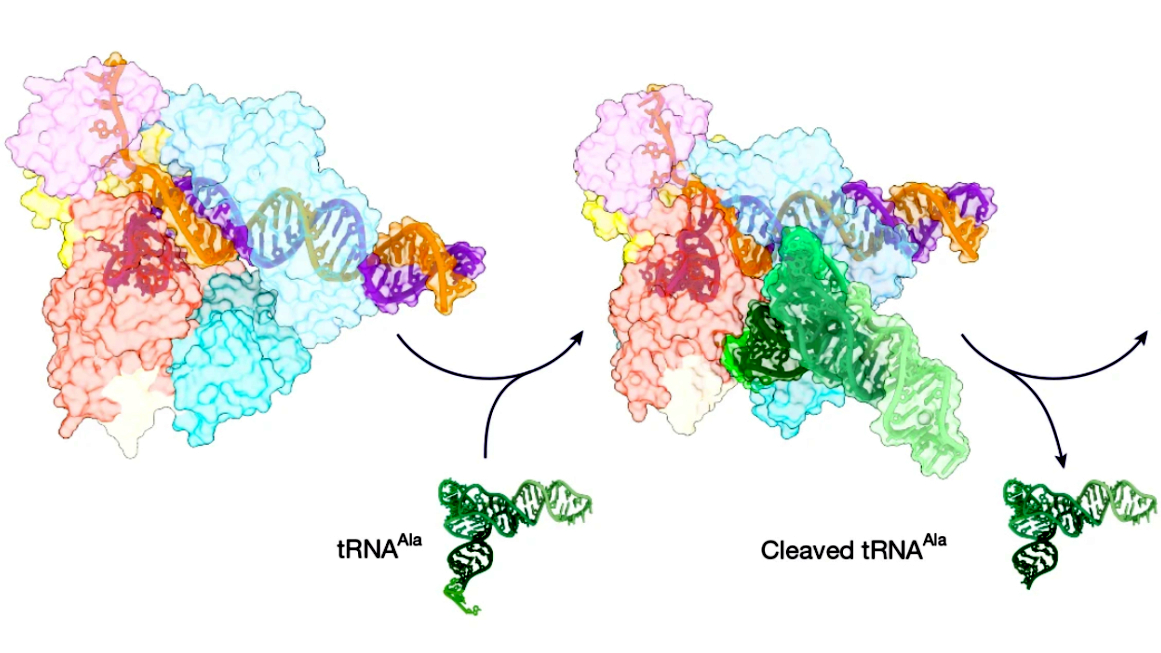
Ein Forschungsteam des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) in Würzburg hat gemeinsam mit weiteren, internationalen Forschungseinrichtungen einen bislang unbekannten CRISPR-Abwehrmechanismus entdeckt. Im Zentrum steht die Nuklease Cas12a3, die sich grundlegend von bekannten CRISPR-Werkzeugen unterscheidet, denn sie schneidet gezielt den sogenannten 3′-Schwanz von Transfer-RNAs (tRNAs).
tRNAs sind essenziell für die Proteinbiosynthese, da sie Aminosäuren zu den Ribosomen transportieren. Wird ihr evolutionär hochkonservierter Schwanz entfernt, kommt die Proteinproduktion zum Erliegen. Die betroffene Zelle verfällt in einen Ruhezustand, wodurch sich Viren nicht weiter vermehren können. Damit beschreibt Cas12a3 eine neue Form der bakteriellen Immunantwort, die CRISPR-Systemen bislang nicht zugeschrieben wurde.
„Dieser Fund war gänzlich unerwartet“, berichtet Chase Beisel vom HIRI, korrespondierender Autor der Studie. Ursprünglich hatte das Team Nukleasen untersucht, die ausschließlich DNA schneiden. Stattdessen stießen die Forschenden auf weitere Mitglieder derselben Proteinfamilie mit völlig anderen Eigenschaften. Ein wissenschaftlicher Glücksfall, der künftig auch praktische Anwendungen ermöglichen könnte.
Neue Perspektiven für biobasierte Technologien
Mithilfe von Kryo-Elektronenmikroskopie konnten die Forschenden zeigen, wie Cas12a3 diese hohe Präzision erreicht: Eine spezielle „tRNA-Ladedomäne“ positioniert den tRNA-Schwanz exakt für den Schnitt. Diese Genauigkeit macht Cas12a3 nicht nur biologisch interessant, sondern auch technologisch relevant. Bereits im Labor wurde das Enzym mit weiteren CRISPR-Nukleasen kombiniert, um RNA von mehreren Viren, darunter Influenza, RSV und SARS-CoV-2, gleichzeitig nachzuweisen.
Für die Bioökonomie eröffnet diese Entdeckung neue Anwendungsfelder, insbesondere in der molekularen Diagnostik. Perspektivisch könnten kostengünstige, einfach einsetzbare Tests entstehen, die auf CRISPR-Technologie basieren. Gleichzeitig unterstreicht die Studie, wie viel ungenutztes Innovationspotenzial in natürlichen biologischen Abwehrmechanismen steckt. Ihre Erforschung kann entscheidende Impulse für die wissensbasierte Bioökonomie liefern.
hb
Lizenzhinweis Titelbild: © Dmytrenko et al., Nature (2026); https://doi.org/10.1038/s41586-025-09852-9; CC-BY 4.0, Bildausschnitt