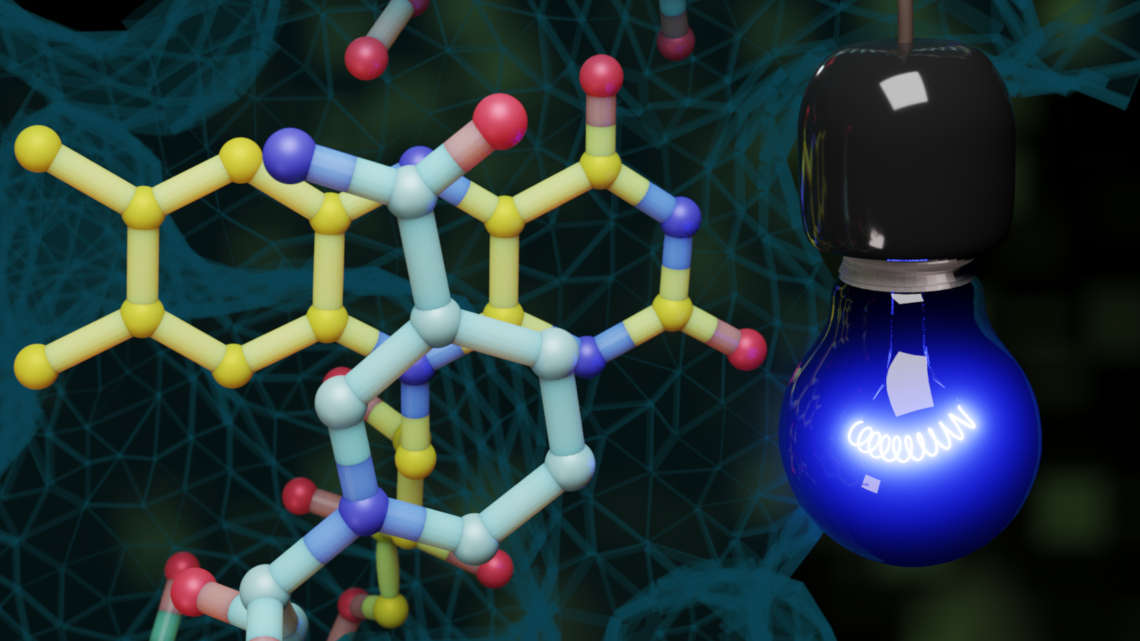
Blaues Licht aktiviert neue Enzymreaktion
Biotechnologen aus Münster haben ein Enzym entdeckt, dessen Sauerstoff-übertragende Aktivität sich durch Licht einschalten lässt.
Enzyme sind die treibenden Kräfte hinter den chemischen Reaktionen in lebenden Zellen. Sie werden deshalb auch als Biokatalysatoren bezeichnet und in biotechnologischen Prozessen eingesetzt, um Reaktionen zu ermöglichen. Wissenschaftler der Westfälischen Wilhelms-Universität Münster (WWU) und der Universität Pavia haben nun ein Enzym entdeckt, das einen in dieser Kombination bislang unbekannten Mechanismus besitzt: Zusätzlich zu seiner normalen Funktion kann durch blaues Licht eine weitere Reaktion ausgelöst werden, die jedoch die Anwesenheit eines bestimmten Moleküls erfordert, wie das Team im Fachjournal „Nature Communications“ berichtet.
Unterschiedliche Anwendungen denkbar
Durch Licht aktivierte, sogenannte fotoaktive Enzyme sind für eine Reihe von Anwendungen relevant. Sie ermöglichen beispielsweise die schrittweise Aktivierung von Reaktionen in einem mehrstufigen Prozess innerhalb eines Reaktionsgefäßes. Auch können auf diese Weise ausschließlich definierte, begrenzte Bereiche einer Oberfläche für eine Reaktion angeschoben werden. Nicht zuletzt erlaubt es dieser Mechanismus, pharmakologische Wirkstoffe so zu designen, dass sie erst infolge der Verstoffwechselung im Körper ihre Wirkung entfalten.
Cofaktor und Cosubstrat erforderlich
Im konkreten Fall stammt das fotoaktive Enzym namens PqsL aus dem Bakterium Pseudomonas aeruginosa und ist eigentlich an Reaktionen beteiligt, die unabhängig von Licht ablaufen. Wird jedoch der am Enzym angeheftete Cofaktor Flavin von Licht getroffen und ist ein sogenanntes NADH-Molekül als Elektronenspender anwesend, nimmt das Flavin zweimal ein Elektron auf und versetzt als Flavinradikal das Enzym PqsL in die Lage, ein Sauerstoffatom auf einen Reaktionspartner zu übertragen.
Weitere lichtaktivierte Enzyme wahrscheinlich
„Das von uns identifizierte Enzym ist Teil einer sehr großen Enzymfamilie, und es ist möglich, dass sich durch genetische Manipulationen weitere lichtschaltbare Enzyme erzeugen lassen, die in unterschiedlichen Anwendungen einsetzbar wären“, betont Studienleiter Steffen Drees vom Institut für Molekulare Mikrobiologie und Biotechnologie der WWU. Gleichzeitig ist es auch denkbar, dass das Enzym so verändert werden kann, dass es andere Reaktionen lichtabhängig ermöglicht, denn sein Flavinradikal weist ein sehr negatives Redoxpotenzial auf, kann also sehr gut Elektronen auf einen Reaktionspartner übertragen: „Aufgrund dieser Eigenschaft vermuten wir, dass auch zusätzliche Reaktionen möglich wären, die das katalytische Potenzial des Enzyms und möglicherweise auch weiterer Flavin-abhängiger Enzyme erweitern“, resümiert Susanne Fetzner, Leiterin der WWU-Forschergruppe.
bl