Spiralstruktur bestimmt Enzymfunktion
Die räumliche Anordnung von Enzymkomplexen steuert, welche Moleküle gebunden werden. Das haben Bochumer Molekularbiologen entdeckt.
Enzyme sind die Chemiefabriken der Zellen. Sie binden Ausgangsmoleküle und katalysieren deren Umsetzung in benötigte Produkte. Entscheidend dafür, welche Ausgangsstoffe ein Enzym verwerten kann, ist die Struktur seines sogenannten aktiven Zentrums. Biotechnologen experimentieren daher mit dem Aufbau der Enzyme, um die chemischen Gruppen in ihrem aktiven Zentrum zu verändern. Dadurch sollen die Enzyme nicht mehr ihre natürlichen Substrate, sondern die für einen industriellen Prozess gewünschten Moleküle binden. Bei dem Enzym Nitrilase war es der Forschung zwar gelungen, chemische Gruppen in deren aktivem Zentrum zu verändern, nicht aber dessen Substratspezifität. Eine deutsch-südafrikanische Kooperation hat nun einen anderen Ansatz erfolgreich umgesetzt.
Oberfläche beeinflusst das Zentrum
Das Team um Markus Piotrowski von der Ruhr-Universität Bochum hat zwei sehr eng miteinander verwandte Nitrilasen genommen, die unterschiedliche Substrate binden. Wie die Biotechnologen im Fachjournal „Communications Biology“ berichten, haben sie die Bausteine dieser Nitrilasen Schritt für Schritt ausgetauscht, um herauszufinden, was den Unterschied in der Substratspezifität erzeugt. Überraschenderweise fanden sie die Antwort nicht im Zentrum, sondern an der Außenseite des Enzyms: „Wir haben festgestellt, dass es ausreicht, einen einzelnen Baustein an der Oberfläche auszutauschen, um dafür zu sorgen, dass das eine Enzym jeweils das Substrat des anderen umsetzt“, erklärt Piotrowski.
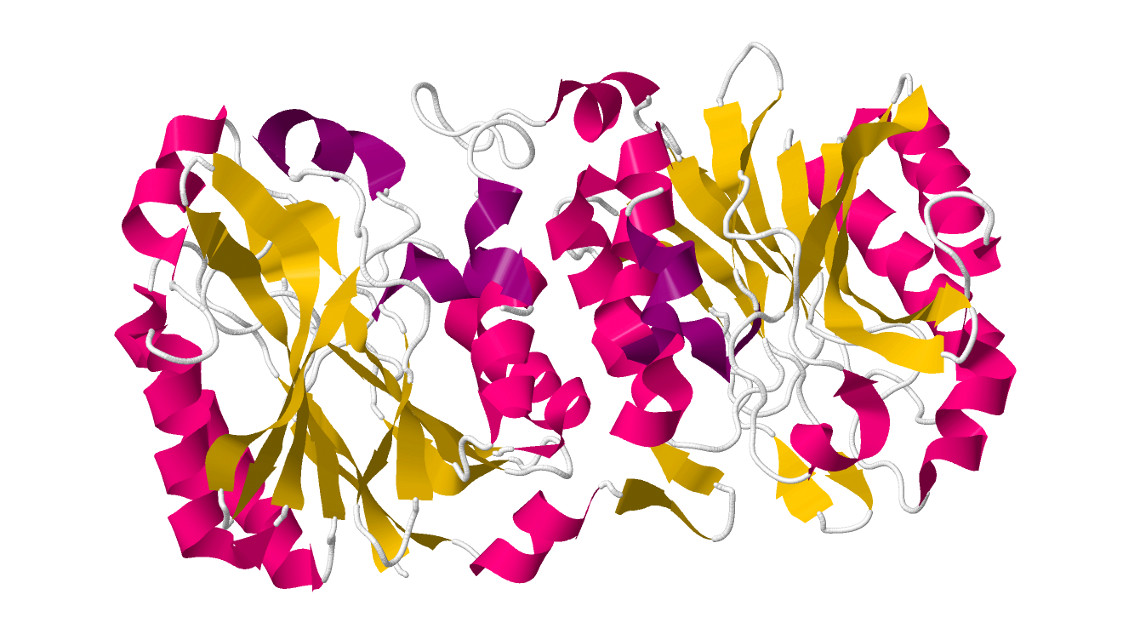
Mit elektronenmikroskopischen Methoden analysierten die Forscher, welche Folgen diese kleine Veränderung für die Raumstruktur des Enzyms hat. „So konnten wir sehen, dass die Veränderung an der Oberfläche zu unterschiedlich dichten Packungen der Enzymmoleküle in der Spirale führt“, beschreibt Piotrowski. Mit der Spirale meint der Forscher die sogenannte Quartärstruktur, zu der sich mehrere Nitrilasen zusammenschließen. Je nachdem, welchen der beiden Bausteine die Nitrilasen besaßen, verlief diese Spirale in engeren oder weiteren Bindungen. „Das führt vermutlich dazu, dass die Substratbindestelle unterschiedlich stark zusammengedrückt wird“, interpretiert der Projektleiter.
Enzymfunktion ändern, ohne das Enzym zu ändern
Für biotechnologische Anwendungen hat das wichtige Implikationen. So könnte sich die Funktion eines Enzyms gezielt beeinflussen lassen, ohne das Enzym selbst in seinem Aufbau zu verändern. „Unsere Ergebnisse zeigen, dass man auf die sogenannte Quartärstruktur achten muss, also die Art, wie sich die einzelnen Enzymmoleküle zusammenlagern“, resümiert Piotrowski. Im Fall der in der pharmazeutischen und chemischen Industrie bereits als Katalysatoren genutzten Nitrilasen würde das bedeuten, die Enzyme in verschieden dichte Spiralstrukturen zu zwängen. Seinen Weg in die Praxis dürfte dieses Forschungsergebnis daher schnell finden.
bl