Molekularen Stickstoff direkt verketten
Chemiker der Universitäten Würzburg und Frankfurt am Main haben ein Verfahren entwickelt, das erstmals ohne Monostickstoffmoleküle als Zwischenschritt auskommt.
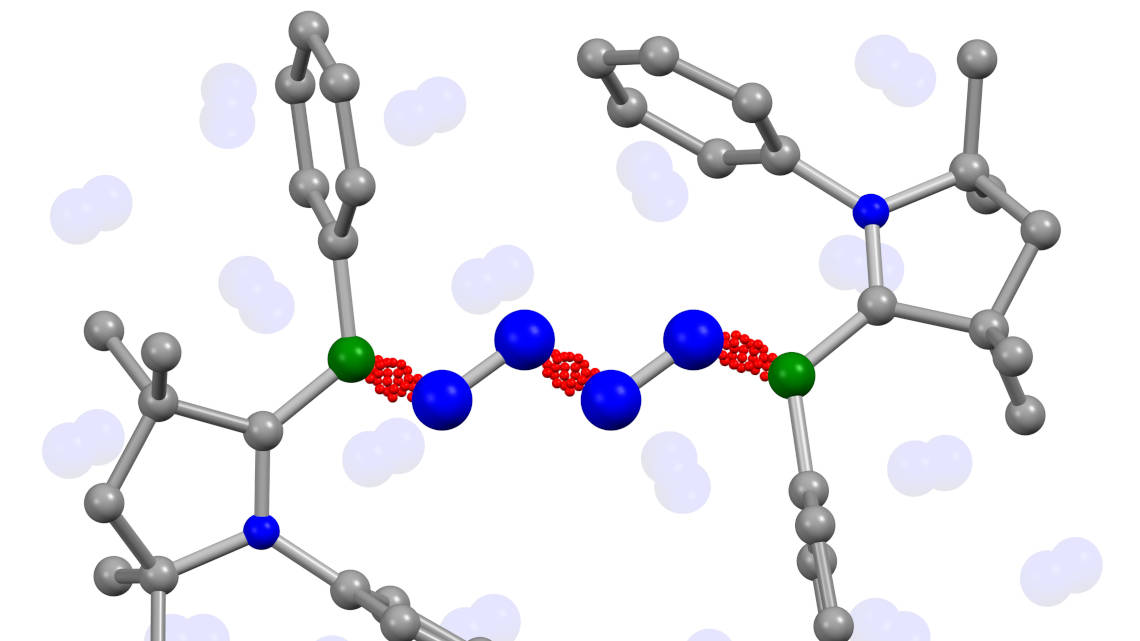
Es ist eine Entdeckung, die eine Menge Energie und Zeit sparen könnte und eine kleine Revolution der chemischen Industrie bedeutet: Forschern der Universitäten Würzburg und Frankfurt am Main ist es erstmals gelungen, Distickstoffmoleküle (N2), die 78% der Atmosphäre bilden, unter relativ milden Reaktionsbedingungen direkt zu verketten. Damit vermeiden sie den Zwischenschritt des energieintensiven Haber-Bosch-Verfahrens, der bislang als unumgänglich galt.
Monostickstoffmoleküle bislang unvermeidlich
Das Haber-Bosch-Verfahren ist ein mehr als hundert Jahre altes Syntheseprinzip der Chemie: Bei 400 bis 500 Grad Celsius und einem Druck zwischen 150 und 350 Bar wird Distickstoff gespalten und Ammoniak (NH3) erzeugt. Erst so wird Stickstoff für weitere chemische Nutzungen verfügbar, denn N2-Moleküle sind sehr stabil und reaktionsträge. Aus Monostickstoffmolekülen wie Ammoniak können Chemiker dann Ketten von Stickstoffatomen synthetisieren, die beispielsweise in der pharmazeutischen Industrie benötigt werden.
Auch Biotechnologie ohne direkten Syntheseweg
Zwar gibt es mit einigen Mikroorganismen durchaus Lebensformen, die mit ihren Enzymen Distickstoff direkt aus der Luft verwerten können. Biotechnologen haben sich dieses Prinzip abgeschaut und Alternativen zum Haber-Bosch-Verfahren entwickelt, die deutlich weniger Energie zur Ammoniakherstellung verbrauchen. Doch auch aus der Biologie ist kein Mechanismus bekannt, der zwei Distickstoffmoleküle direkt miteinander verkettet.
Jetzt: direkte Synthese bei milden Bedingungen
Im Fachjournal „Science“ berichten Chemiker der Universitäten Würzburg und Frankfurt am Main nun von einer vollkommen neuen chemischen Reaktion. Bei milden Bedingungen von minus 30 Grad Celsius und 4Bar Stickstoffdruck konnten sie kettenförmige Stickstoffmoleküle direkt aus Distickstoff synthetisieren. Der für diese Reaktion bisher erforderliche Metallkatalysator wurde ebenfalls nicht benötigt.
Neue Möglichkeiten für die Chemie
„Mithilfe aufwendiger Computersimulationen gelang es uns, die unerwartet komplizierten Bindungsverhältnisse in diesen wunderschönen Molekülen zu verstehen. Damit können wir zukünftig Prognosen zur Stabilität solcher Stickstoffketten aufstellen und unsere experimentellen Partner bei der Weiterentwicklung ihrer Entdeckung unterstützen“, sagt der Würzburger Chemieprofessor Holger Braunschweig. „Damit wird der Weg frei für eine Chemie, mit der völlig neue, kettenförmige Stickstoffmoleküle synthetisiert werden können“, erläutert er. Denn nicht zuletzt könnten auf diesem Weg auch bestimmte Isotope von Stickstoff problemlos verkettet werden.
Die Arbeit der Chemiker wurde von der Deutschen Forschungsgemeinschaft, Postdoc-Stipendien des „Natural Sciences and Engineering Research Council of Canada“ und der Alexander-von-Humboldt-Stiftung unterstützt. In einem nächsten Schritt möchten die Chemiker nun die Stickstoffketten in organische Verbindungen für Pharmazie und Medizin einbauen.
bl


